Γιατί οι δεσμοί υδρογόνου είναι ισχυρότεροι;
Εδώ είναι γιατί:
* ομοιοπολικοί δεσμοί: Αυτά περιλαμβάνουν την ανταλλαγή ζευγών ηλεκτρονίων μεταξύ των ατόμων. Τα κοινόχρηστα ηλεκτρόνια προσελκύονται έντονα και από τους δύο πυρήνες, με αποτέλεσμα έναν πολύ ισχυρό δεσμό.
* Ιονικά ομόλογα: Αυτά περιλαμβάνουν την ηλεκτροστατική έλξη μεταξύ των αντίθετα φορτισμένων ιόντων. Αυτό το αξιοθέατο είναι επίσης αρκετά ισχυρό.
* δεσμούς υδρογόνου: Πρόκειται για έναν ειδικό τύπο αλληλεπίδρασης διπολικής-διπόλης που εμφανίζεται μεταξύ ενός ατόμου υδρογόνου που συνδέεται ομοιοπολικά με ένα πολύ ηλεκτροαρνητικό άτομο (όπως το οξυγόνο, το άζωτο ή το φθοριοειδές) και ένα ζεύγος ηλεκτρονίων σε ένα γειτονικό ηλεκτροαρνητικό άτομο. Αυτή η αλληλεπίδραση είναι ασθενέστερη από τους ομοιοπολικούς ή ιοντικούς δεσμούς επειδή βασίζεται στην έλξη μεταξύ μερικώς θετικών και μερικώς αρνητικών χρεώσεων.
Ωστόσο, οι δεσμοί υδρογόνου εξακολουθούν να είναι σημαντικοί για διάφορους λόγους:
* Είναι σχετικά ισχυροί σε σύγκριση με άλλες διαμοριακές δυνάμεις: Είναι ισχυρότερα από τις δυνάμεις van der Waals, για παράδειγμα, οι οποίες είναι υπεύθυνες για τα αξιοθέατα μεταξύ των μη πολικών μορίων.
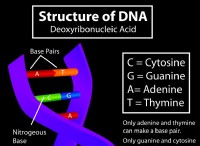
* Παίζουν κρίσιμο ρόλο σε πολλές βιολογικές διαδικασίες: Είναι υπεύθυνοι για τη συγκράτηση της διπλής έλικας DNA, τη σταθεροποίηση των πρωτεϊνικών δομών και τη διευκόλυνση των μοναδικών ιδιοτήτων του νερού.
Συνοπτικά, οι δεσμοί υδρογόνου δεν είναι ο ισχυρότερος τύπος δεσμού, αλλά είναι αρκετά ισχυροί για να είναι σημαντικοί σε βιολογικά και χημικά συστήματα.