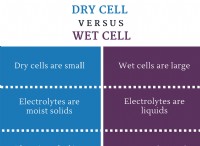
Ποια είναι η διαφορά μεταξύ της σύνθεσης δυαδικών ιοντικών και μοριακών ενώσεων;
Διαφορές σύνθεσης:Δυαδική ιωνική έναντι μοριακών ενώσεων
Ακολουθεί μια ανάλυση των βασικών διαφορών στη σύνθεση μεταξύ δυαδικών ιοντικών και μοριακών ενώσεων:
Δυαδικές ιοντικές ενώσεις:
* Σύνθεση: Αποτελούνται από δύο στοιχεία, ένα μέταλλο (κατιόν) και ένα μη μέταλλο (ανιόν).
* δεσμός: Οι ιοντικοί δεσμοί που σχηματίζονται με ηλεκτροστατική έλξη μεταξύ αντιθέτων ιόντων.
* Φόρμουλα: Χρησιμοποιεί το χαμηλότερο λόγο ολόκληρου αριθμού των ιόντων που απαιτούνται για την επίτευξη ηλεκτρικής ουδετερότητας. Αυτό είναι γνωστό ως ο εμπειρικός τύπος .
* Παράδειγμα: NaCl (χλωριούχο νάτριο) - Ένα ιόν Na⁺ συνδυάζεται με ένα ιόν CL⁻.
δυαδικές μοριακές ενώσεις:
* Σύνθεση: Αποτελούνται από δύο μη μέταλλα στοιχεία.
* δεσμός: Ομοιοπολικοί δεσμοί, όπου τα άτομα μοιράζονται ηλεκτρόνια για να επιτευχθούν σταθερή διαμόρφωση ηλεκτρονίων.
* Φόρμουλα: Αντιπροσωπεύει τον πραγματικό αριθμό ατόμων κάθε στοιχείου που υπάρχει σε ένα μόριο.
* Παράδειγμα: CO₂ (διοξείδιο του άνθρακα) - ένας δεσμός ατόμων άνθρακα με δύο άτομα οξυγόνου.
Περίληψη διαφορών βασικών:
| Χαρακτηριστικό | Δυαδική ιοντική ένωση | Δυαδική μοριακή ένωση |
| -------------------------------------------------------------------------------------------------------------------------------------------------------------
| Στοιχεία | Metal &Nonaltal | Δύο μη μέταλλα |
| Δεσμός | Ιωνική (ηλεκτροστατική) Ομοιοπολικό (κοινή χρήση) |
| Αντιπροσώπευση τύπου | Εμπειρική φόρμουλα | Μοριακός τύπος |
Σημαντική σημείωση: Ορισμένες ενώσεις μπορούν να εμφανίζουν τόσο ιοντικό όσο και ομοιοπολικό χαρακτήρα, οδηγώντας σε "πολυατομικά ιόντα" μέσα στην ιοντική ένωση. Αυτές οι ενώσεις δεν είναι αυστηρά δυαδικές ιοντικές, αλλά μοιράζονται κάποια χαρακτηριστικά μαζί τους.
Παράδειγμα: NH₄Cl (χλωριούχο αμμωνίου) - Το NH₄⁺ είναι ένα πολυατομικό ιόν (ομοιοπολικοί δεσμοί εντός του ιόντος) που σχηματίζει μια ιοντική ένωση με CL⁻.