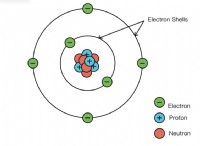
Πώς είναι η μακροσκοπική ιδιότητα του μορίου του μορίου;
1. Φυσικές ιδιότητες:
* Σημεία τήξης και βρασμού: Οι ισχυροί δεσμοί (όπως ιοντικοί ή ομοιοπολικοί) απαιτούν περισσότερη ενέργεια για να σπάσει, οδηγώντας σε υψηλότερα σημεία τήξης και βρασμού.
* σκληρότητα: Τα υλικά με ισχυρούς δεσμούς είναι συνήθως πιο δύσκολα από εκείνα με ασθενέστερους δεσμούς.
* Διαλυτότητα: Η ικανότητα μιας ουσίας να διαλύεται σε έναν διαλύτη επηρεάζεται από τους τύπους αλληλεπιδράσεων μεταξύ των μορίων διαλυμένης ουσίας και διαλύτη. Τα πολικά μόρια (με πολικούς δεσμούς) τείνουν να διαλύονται σε πολικούς διαλύτες όπως το νερό, ενώ τα μη πολικά μόρια (με μη πολικούς δεσμούς) διαλύονται σε μη πολικούς διαλύτες όπως το πετρέλαιο.
* αγωγιμότητα: Οι ιοντικές ενώσεις διεξάγουν ηλεκτρική ενέργεια όταν λιωθούν ή διαλύονται σε νερό επειδή τα ιόντα τους είναι ελεύθερα να κινηθούν. Οι ομοιοπολικές ενώσεις, από την άλλη πλευρά, είναι γενικά κακοί αγωγοί, εκτός αν είναι πολύ πολικοί ή έχουν αποσυνδεδεμένα ηλεκτρόνια.
* Πυκνότητα: Η πυκνότητα επηρεάζεται από τη συσκευασία μορίων σε μια ουσία. Οι ισχυροί δεσμοί συχνά οδηγούν σε πυκνότερα υλικά.
2. Χημικές ιδιότητες:
* Αντιδραστικότητα: Η δύναμη των δεσμών υπαγορεύει πόσο εύκολα ένα μόριο θα αντιδράσει με άλλες ουσίες. Οι ασθενέστεροι δεσμοί είναι ευκολότερο να σπάσουν, οδηγώντας σε υψηλότερη αντιδραστικότητα.
* σταθερότητα: Τα μόρια με ισχυρούς δεσμούς είναι γενικά πιο σταθερά και λιγότερο πιθανό να αποσυντεθούν.
* πολικότητα: Οι πολικοί δεσμοί, όπου τα ηλεκτρόνια μοιράζονται άνισα, δημιουργούν πολικά μόρια που μπορούν να αλληλεπιδρούν με άλλα πολικά μόρια ή ιόντα. Αυτό επηρεάζει την ικανότητα του μορίου να συμμετέχει σε διάφορες χημικές αντιδράσεις.
Παραδείγματα:
* Diamond εναντίον γραφίτη: Και τα δύο είναι κατασκευασμένα από άτομα άνθρακα, αλλά η συγκόλληση είναι διαφορετική. Στο Diamond, κάθε άνθρακα σχηματίζει τέσσερις ισχυρούς ομοιοπολικούς δεσμούς σε μια τετραεδρική διάταξη, καθιστώντας το εξαιρετικά δύσκολο. Σε γραφίτη, τα άτομα άνθρακα σχηματίζουν επίπεδα φύλλα με ασθενέστερους δεσμούς, καθιστώντας το μαλακό και νιφάδες.
* νερό (h₂o): Οι πολικοί ομοιοπολικοί δεσμοί στο νερό δημιουργούν ισχυρούς δεσμούς υδρογόνου μεταξύ των μορίων του νερού, οδηγώντας σε ένα υψηλό σημείο τήξης και βρασμού, υψηλής επιφανειακής τάσης και την ικανότητά του να δρα ως διαλύτης.
* Χλωριούχο νάτριο (NaCl): Η ιοντική συγκόλληση σε χλωριούχο νάτριο το καθιστά ένα σκληρό, εύθραυστο στερεό με υψηλό σημείο τήξης. Διαλύεται εύκολα στο νερό λόγω της ισχυρής έλξης μεταξύ των ιόντων και των μορίων νερού.
Συνοπτικά:
Η συγκόλληση σε ένα μόριο καθορίζει τη δομή του και τον τρόπο που αλληλεπιδρά με άλλα μόρια. Αυτό τελικά επηρεάζει τις μακροσκοπικές του ιδιότητες όπως το σημείο τήξης, τη σκληρότητα, την αγωγιμότητα, την αντιδραστικότητα και τη διαλυτότητα.