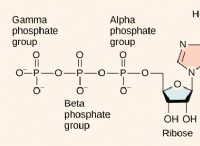
Οι ομοιοπολικοί δεσμοί έχουν σημεία τήξης;
Εδώ είναι γιατί:
* ομοιοπολικοί δεσμοί: Αυτοί είναι ισχυροί δεσμοί που σχηματίζονται από την ανταλλαγή ηλεκτρονίων μεταξύ των ατόμων. Διατηρούν άτομα μαζί σε μόρια.
* Σημείο τήξης: Η θερμοκρασία στην οποία μεταβαίνει μια στερεά ουσία σε υγρή κατάσταση.
* ομοιοπολικές ενώσεις: Αυτές είναι ουσίες που σχηματίζονται από ομοιοπολικούς δεσμούς. Έχουν συγκεκριμένα σημεία τήξης λόγω της δύναμης των δεσμών μεταξύ των μορίων.
Παράγοντες που επηρεάζουν το σημείο τήξης των ομοιοπολικών ενώσεων:
* Αντοχή ομοιοπολικών δεσμών: Οι ισχυρότεροι ομοιοπολικοί δεσμοί απαιτούν περισσότερη ενέργεια για να σπάσει, με αποτέλεσμα υψηλότερα σημεία τήξης.
* Διαμοριακές δυνάμεις: Αυτές είναι ασθενέστερες δυνάμεις που υπάρχουν μεταξύ των μορίων. Περιλαμβάνουν δυνάμεις όπως η δέσμευση υδρογόνου, οι αλληλεπιδράσεις διπόλης-διπόλης και οι δυνάμεις διασποράς του Λονδίνου. Οι ισχυρότερες διαμοριακές δυνάμεις συμβάλλουν σε υψηλότερα σημεία τήξης.
* Μοριακό μέγεθος και σχήμα: Τα μεγαλύτερα μόρια έχουν περισσότερη επιφάνεια, οδηγώντας σε ισχυρότερες ενδομοριακές δυνάμεις και υψηλότερα σημεία τήξης.
* Συμμετρία: Τα συμμετρικά μόρια τείνουν να συσκευάζουν πιο σφιχτά, με αποτέλεσμα ισχυρότερες ενδομοριακές δυνάμεις και υψηλότερα σημεία τήξης.
Παραδείγματα:
* Diamond: Ένα ομοιοπολικό δίκτυο στερεά με πολύ ισχυρούς δεσμούς άνθρακα-άνθρακα. Έχει ένα εξαιρετικά υψηλό σημείο τήξης (περίπου 3550 ° C).
* νερό: Μια ομοιοπολική ένωση με ισχυρούς δεσμούς υδρογόνου μεταξύ των μορίων. Το σημείο τήξης του είναι 0 ° C.
* μεθάνιο (CH4): Μια ομοιοπολική ένωση με μόνο αδύναμες δυνάμεις διασποράς του Λονδίνου. Το σημείο τήξης του είναι -182,5 ° C.
Συμπερασματικά, ενώ οι ίδιοι οι ομοιοπολικοί δεσμοί δεν λιώνουν, οι ενώσεις που σχηματίζονται από ομοιοπολικούς δεσμούς έχουν συγκεκριμένα σημεία τήξης που επηρεάζονται από τη δύναμη των δεσμών και άλλων παραγόντων.