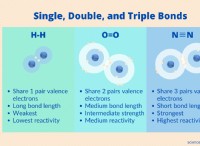
Το νερό έχει υψηλή ειδική θερμότητα λόγω της σύνδεσης υδρογόνου μεταξύ των μορίων;
* δεσμός υδρογόνου: Τα μόρια του νερού είναι πολικά, με το άτομο οξυγόνου να έχει μερικό αρνητικό φορτίο και τα άτομα υδρογόνου να έχουν μερικό θετικό φορτίο. Αυτή η πολικότητα επιτρέπει στους ισχυρούς δεσμούς υδρογόνου να σχηματίζονται μεταξύ των μορίων του νερού.
* Οι δεσμοί θραύσης απαιτούν ενέργεια: Αυτοί οι δεσμοί υδρογόνου απαιτούν μια σημαντική ποσότητα ενέργειας για να σπάσει. Όταν η θερμότητα εφαρμόζεται στο νερό, δεν αυξάνεται μόνο η κινητική ενέργεια των μορίων (καθιστώντας τα πιο γρήγορα), αλλά και να σπάσουν αυτούς τους δεσμούς.
* Υψηλή ειδική θερμότητα: Η μεγάλη ποσότητα ενέργειας που απαιτείται για να σπάσει αυτούς τους δεσμούς σημαίνει ότι το νερό μπορεί να απορροφήσει πολλή θερμότητα χωρίς να υποβληθεί σε μεγάλη αλλαγή θερμοκρασίας. Αυτός είναι ο λόγος για τον οποίο το νερό έχει υψηλή ειδική θερμική χωρητικότητα - την ποσότητα θερμότητας που απαιτείται για την αύξηση της θερμοκρασίας ενός γραμμάρια νερού κατά ένα βαθμό Κελσίου.
Συνοπτικά: Η συγκόλληση υδρογόνου του νερού είναι ο πρωταρχικός λόγος για την υψηλή ειδική θερμική ικανότητα του. Αυτή η ιδιοκτησία είναι ζωτικής σημασίας για τη ζωή στη Γη, καθώς βοηθά στη ρύθμιση των θερμοκρασιών, στα μέτρια κλίματα και στη διατήρηση σταθερών περιβαλλόντων για τους οργανισμούς.