Καταλύτες &Ενέργεια Ενεργοποίησης
Τι είναι ο καταλύτης;
Ας μιλήσουμε για το τι είναι καταλύτης. Ένας καταλύτης είναι μια ένωση ή στοιχείο που αυξάνει τον ρυθμό μιας χημικής αντίδρασης, π.χ. την ταχύτητα με την οποία εμφανίζεται, χωρίς η ίδια να αποτελεί μέρος της αντίδρασης. Σε γενικές γραμμές, ένας καταλύτης δεν καταστρέφεται ούτε αλλάζει στην αντίδραση. Ένας καταλύτης το κάνει αυτό μειώνοντας την ενέργεια ενεργοποίησης , το οποίο εξηγούμε στην επόμενη ενότητα
Τι είναι η ενέργεια ενεργοποίησης;
Με απλά λόγια, ο ορισμός της ενέργειας ενεργοποίησης είναι η ενέργεια που απαιτείται για να ξεκινήσει μια αντίδραση μεταξύ δύο ή περισσότερων στοιχείων ή ενώσεων. Μια αντίδραση με υψηλή ενέργεια ενεργοποίησης μπορεί να προχωρήσει αργά ή και καθόλου. Για να επιταχύνετε ή να ξεκινήσετε μια αντίδραση, μπορείτε είτε να προσθέσετε την απαραίτητη ενέργεια ενεργοποίησης είτε να χρησιμοποιήσετε έναν καταλύτη που μειώνει αυτήν την απαίτηση, επιταχύνοντας ουσιαστικά την αντίδραση.
Οι ενεργειακές μονάδες ενεργοποίησης είναι ως προς τις ενεργειακές μονάδες. Οι πιο κοινές μονάδες που χρησιμοποιούνται είναι KJ/mol ή J/mol.
Πώς λειτουργεί ένας καταλύτης;
Ένας καταλύτης αυξάνει τον ρυθμό αντίδρασης μειώνοντας την ενέργεια ενεργοποίησης. Μειωμένη ενέργεια ενεργοποίησης σημαίνει λιγότερη ενέργεια που απαιτείται για την έναρξη της αντίδρασης.
Το παρακάτω γράφημα δείχνει την ενέργεια μιας αντίδρασης με και χωρίς παρουσία καταλύτη. Ο άξονας x είναι η συντεταγμένη αντίδρασης ή η εξέλιξη της αντίδρασης από το αντιδρών (αριστερή πλευρά) στο προϊόν (δεξιά πλευρά). Ο άξονας y είναι η ενέργεια.
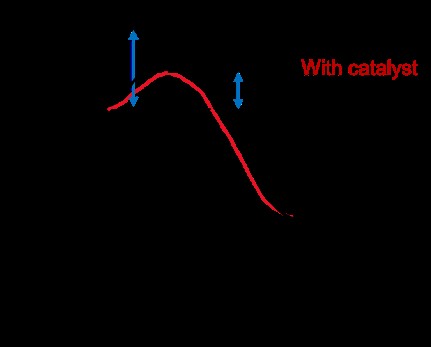
Με τον καταλύτη παρόντα, η ενέργεια ενεργοποίησης (Ea ) είναι μικρότερο. Οπτικά, ο λόφος που πρέπει να σκαρφαλώσει η αντίδραση πριν κατέβει προς τα προϊόντα είναι μικρότερος. Ακριβώς όπως η οδήγηση ενός ποδηλάτου σε μια μικρή ανηφόρα είναι ευκολότερη από μια μεγαλύτερη ανηφόρα, μια αντίδραση προχωρά πιο γρήγορα όταν η ενεργειακή ανηφόρα ενεργοποίησης είναι μικρότερη.
Ένας καταλύτης μειώνει την ενέργεια ενεργοποίησης αλλάζοντας τη μεταβατική κατάσταση της αντίδρασης. Στη συνέχεια, η αντίδραση περνά από διαφορετικό μονοπάτι/μηχανισμό από τη μη καταλυόμενη αντίδραση. Ο καταλύτης δεν αλλάζει την καθαρή διαφορά ενέργειας μεταξύ αντιδραστηρίου και προϊόντος. Η καθαρή εξίσωση της αντίδρασης θα είναι η ίδια σε μια καταλυόμενη και μη καταλυόμενη αντίδραση, παρόλο που αλλάζει η κατάσταση μετάβασης.
Συνολική αντίδραση:A + B + καταλύτης –> AB + καταλύτης
Καθαρή αντίδραση:A + B –> AB
Κύριες Κατηγορίες Καταλύτη
Ετερογενής Καταλύτης
Ένας ετερογενής καταλύτης βρίσκεται σε διαφορετική φάση από τα αντιδρώντα. Συνήθως, αυτό σημαίνει ότι ο καταλύτης βρίσκεται στη στερεή φάση και τα αντιδραστήρια βρίσκονται σε υγρή ή αέρια φάση. Ένα άλλο όνομα για έναν ετερογενή καταλύτη είναι ένας καταλύτης επιφάνειας.
Οι ετερογενείς καταλύτες λειτουργούν συνδέοντας τον καταλύτη σε μια στερεή δομή στήριξης και τα αντιδρώντα ρέουν πάνω και πέρα από τον καταλύτη, αντιδρώντας στην πορεία. Ένα πλεονέκτημα αυτού του τύπου καταλύτη είναι ότι ο καταλύτης διαχωρίζεται εύκολα από το προϊόν όταν ολοκληρωθεί η αντίδραση. Ο καταλύτης μπορεί στη συνέχεια να επαναχρησιμοποιηθεί εύκολα. Στον τομέα της μεταποίησης, αυτό είναι ένα σημαντικό μέτρο μείωσης του κόστους. Ένα μειονέκτημα του ετερογενούς καταλύτη είναι ότι η ποσότητα της αλληλεπίδρασης μεταξύ του αντιδρώντος και του καταλύτη μπορεί να περιοριστεί από την επιφάνεια και τη διάχυση του προϊόντος μακριά από την επιφάνεια.
Ένας κοινός ετερογενής καταλύτης είναι ένας καταλυτικός μετατροπέας για τη βενζίνη στα αυτοκίνητα. Ένας άλλος σημαντικός ετερογενής καταλύτης είναι η διαδικασία Haber-Bosch που σχηματίζει NH3 .
Ομογενής Καταλύτης
Σε έναν ομοιογενή καταλύτη, τόσο τα αντιδρώντα όσο και ο καταλύτης βρίσκονται στην ίδια φάση. Κανονικά είναι και οι δύο σε υγρή ή αέρια φάση.
Το κύριο πλεονέκτημα ενός ομοιογενούς καταλύτη είναι η αυξημένη αλληλεπίδραση μεταξύ αντιδρώντος και καταλύτη. Και τα δύο μπορούν να κινούνται ελεύθερα και επομένως είναι πιο πιθανό να αλληλεπιδράσουν και να οδηγήσουν σε αντίδραση.
Κοινοί ομοιογενείς καταλύτες είναι τα μέταλλα μετάπτωσης και τα οξέα. Μια ομοιογενής καταλυόμενη αντίδραση είναι η μετατροπή του οξυγόνου σε όζον στην ατμόσφαιρα. Το μονοξείδιο του αζώτου (ΝΟ) καταλύει την αντίδραση. Όλοι οι συμμετέχοντες στην αντίδραση βρίσκονται στην αέρια φάση. Επομένως γνωρίζουμε ότι είναι μια ομοιογενής καταλυτική αντίδραση.
Ένζυμα
Τα ένζυμα είναι μεγάλες πρωτεΐνες που είναι βιολογικοί καταλύτες. Είναι ισχυρές δυνάμεις στο σώμα. Συχνά καταλύουν μόνο μία πολύ συγκεκριμένη αντίδραση (σε σύγκριση με ανόργανους καταλύτες που συχνά καταλύουν ένα πολύ ευρύτερο σύνολο αντιδράσεων). Η εξειδίκευση οφείλεται στη δραστική θέση στον καταλύτη - έναν θύλακα ειδικής χημικής σύνθεσης που σχηματίζεται από αμινοξέα όπου χωράει μόνο ένα πολύ συγκεκριμένο μοντέλο αντιδραστηρίου. Αυτό αναφέρεται επίσης ως το μοντέλο κλειδώματος και κλειδιού.
Τα ένζυμα παίζουν πολλούς σημαντικούς ρόλους στο σώμα. Καταλύουν τη διάσπαση του αμύλου για να δημιουργήσουν γλυκόζη. Μετατρέπουν επίσης το διοξείδιο του άνθρακα (CO2 ) σε άλλα μόρια που χρειάζεται το σώμα όπως το HCO3 . Τα ένζυμα βοηθούν και επιταχύνουν σχεδόν όλες τις διαδικασίες στο σώμα.
Υπολογισμός ενέργειας ενεργοποίησης
Οι υπολογισμοί της ενέργειας ενεργοποίησης χρησιμοποιούν την εξίσωση Arrhenius. Τα βασικά θα καλυφθούν εδώ, αλλά για περισσότερα παραδείγματα και σε βάθος ανάλυση φροντίστε να ανατρέξετε στο άρθρο της εξίσωσης Arrhenius.
Η εξίσωση Arrhenius είναι:
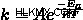
Οπου 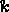 είναι σταθερά ταχύτητας,
είναι σταθερά ταχύτητας, 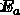 είναι η ενέργεια ενεργοποίησης,
είναι η ενέργεια ενεργοποίησης, 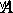 είναι ο παράγοντας συχνότητας,
είναι ο παράγοντας συχνότητας, 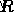 είναι η σταθερά αερίου και
είναι η σταθερά αερίου και 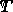 είναι η θερμοκρασία.
είναι η θερμοκρασία.
Μπορούμε να βρούμε την ενέργεια ενεργοποίησης αν γνωρίζουμε τη σταθερά ρυθμού ( 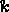 ) σε διάφορες θερμοκρασίες (
) σε διάφορες θερμοκρασίες ( 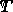 ). Για να προσδιορίσετε την ενέργεια ενεργοποίησης (
). Για να προσδιορίσετε την ενέργεια ενεργοποίησης ( 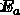 ) σχεδιάζουμε
) σχεδιάζουμε 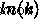 εναντίον
εναντίον 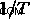 . Με αυτόν τον τρόπο, παίρνουμε μια γραμμή με κλίση -
. Με αυτόν τον τρόπο, παίρνουμε μια γραμμή με κλίση - 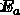 /
/ 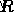 και μια τομή y του
και μια τομή y του 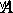 .
. 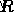 είναι μια σταθερά, οπότε μπορούμε να λύσουμε την ενέργεια ενεργοποίησης.
είναι μια σταθερά, οπότε μπορούμε να λύσουμε την ενέργεια ενεργοποίησης.
Για παράδειγμα προβλήματα στον τύπο ενέργειας ενεργοποίησης, δείτε τη σελίδα εξίσωσης Arrhenius!
Κατάλογος κοινών καταλυτών:
- Πεντοξείδιο του βαναδίου (που παράγει θειικό οξύ)
- Μέταλλο παλλάδιο
- Διοξείδιο του μαγγανίου
- Μέταλλο πλατίνα (σε καταλυτικούς μετατροπείς)
- Μέταλλο σιδήρου (στη διαδικασία Haber)
- Χλωριούχο αργίλιο (πολλές οργανικές αντιδράσεις)
- Οξείδιο του χαλκού (II)
- Ένζυμα (φυσικοί καταλύτες σε βιοχημικές αντιδράσεις)
Ορισμοί λεξιλογίου καταλύτη και ενέργειας ενεργοποίησης
- Ενέργεια ενεργοποίησης – ενέργεια που απαιτείται για την έναρξη μιας αντίδρασης μεταξύ δύο ή περισσότερων στοιχείων ή ενώσεων
- Καταλύτης – Μόριο που αυξάνει τον ρυθμό αντίδρασης και δεν καταναλώνεται στην αντίδραση
- Αριθμός κύκλου εργασιών – ο αριθμός των αντιδράσεων που μπορεί να καταλύσει ένα ένζυμο ανά δευτερόλεπτο
- Ένζυμο – ένας βιολογικός καταλύτης από αμινοξέα.
- Μοντέλο κλειδώματος- Το μοντέλο ότι ένα ένζυμο και το μόριο του αντιδρώντος έχουν παρόμοιο σχήμα στην ενεργό θέση για να αυξήσουν την ειδικότητα και την αποτελεσματικότητα της αντίδρασης.
- Ομογενής Καταλύτης – Ένας καταλύτης που υπάρχει στην ίδια φάση με τα αντιδρώντα.
- Ετερογενής Καταλύτης- Ένας καταλύτης σε διαφορετική φάση από τα αντιδρώντα.
Ελπίζουμε να γνωρίζετε τώρα τι είναι ένας καταλύτης, πώς επηρεάζουν μια αντίδραση και πώς μπαίνει στο παιχνίδι η ενέργεια ενεργοποίησης. Αυτές οι έννοιες θα γίνουν πιο σημαντικές εάν εμβαθύνετε στην κινητική των χημικών αντιδράσεων. Ευχαριστούμε που επισκεφθήκατε το ChemTalk!




