Διαφορά μεταξύ ανόδου και καθόδου
Κύρια διαφορά – Άνοδος έναντι καθόδου
Οι όροι κάθοδος και άνοδος χρησιμοποιούνται για να αναφέρονται σε ακροδέκτες μιας πολωμένης ηλεκτρικής συσκευής. Η κύρια διαφορά μεταξύ ανόδου και καθόδου είναι ότι, γενικά, άνοδος είναι το τερματικό όπου το (συμβατικό) ρεύμα ρέει σε μια συσκευή από έξω , ενώ η κάθοδος είναι το τερματικό όπου το (συμβατικό) ρεύμα ρέει έξω από τη συσκευή . Ωστόσο, η χρήση δεν ακολουθείται αυστηρά σε ορισμένες περιπτώσεις, επειδή όταν μια συσκευή είναι σε θέση να υποβληθεί σε μια αναστρέψιμη διαδικασία, το ίδιο τερματικό που ονομαζόταν "άνοδος" θα μπορούσε τώρα να ονομάζεται "κάθοδος". Αναμφίβολα, αυτό μπορεί να οδηγήσει σε σύγχυση και καλό είναι να προσαρμοστείτε στη γενική χρήση στο συγκεκριμένο πεδίο. Σε αυτό το άρθρο, θα εξετάσουμε διάφορα σενάρια όπου χρησιμοποιούνται αυτοί οι όροι και θα διερευνήσουμε τη χρήση τους όσον αφορά τις διαδικασίες που πραγματοποιούνται σε αυτές τις συσκευές.
Τι είναι η άνοδος
Η άνοδος είναι το τερματικό όπου το (συμβατικό) ρεύμα ρέει σε μια συσκευή από έξω. Αυτό σημαίνει ότι τα ηλεκτρόνια ρέει έξω από τη συσκευή στην άνοδο.
Τι είναι η Κάθοδος
Η κάθοδος είναι το τερματικό όπου το (συμβατικό) ρεύμα ρέει έξω από μια συσκευή. Αυτό σημαίνει ότι τα ηλεκτρόνια ροή σε αυτό το τερματικό από έξω.
Γαλβανικά/Βολταϊκά Κυψέλες
Η ρύθμιση ενός γαλβανικού στοιχείου φαίνεται παρακάτω:

Μια γαλβανική κυψέλη
Σε ένα γαλβανικό στοιχείο, ένα από τα ηλεκτρόδια έχει υψηλότερο δυναμικό μείωσης από το άλλο. Το ηλεκτρόδιο με υψηλότερο δυναμικό μείωσης έχει ισχυρότερη ικανότητα να αποκτά ηλεκτρόνια, έτσι τα ηλεκτρόνια ρέουν σε αυτό από το άλλο ηλεκτρόδιο. Στο κελί που σχεδιάστηκε παραπάνω, ο χαλκός έχει υψηλότερο δυναμικό μείωσης από τον ψευδάργυρο, επομένως αντλεί ηλεκτρόνια από το ηλεκτρόδιο ψευδαργύρου. Αυτό συνοδεύει δύο αντιδράσεις. Στο ηλεκτρόδιο ψευδαργύρου, ο ψευδάργυρος διασπάται σε ιόντα Zn και ηλεκτρόνια. Με άλλα λόγια, ο ψευδάργυρος οξειδώνεται (χάνει ηλεκτρόνια).

Τα ηλεκτρόνια που χάνονται από τον ψευδάργυρο ρέουν στα καλώδια στο χάλκινο ηλεκτρόδιο. Εδώ, τα εισερχόμενα ηλεκτρόνια συνδυάζονται με ιόντα Cu και σχηματίζουν άτομα χαλκού. Ο χαλκός μειώνεται (κερδίζει ηλεκτρόνια):

Εδώ, τα ηλεκτρόνια ρέουν "έξω από τη συσκευή" από το τερματικό ψευδάργυρου, επομένως το συμβατικό ρεύμα ρέει στη συσκευή εδώ. Αυτό καθιστά το τερματικό ψευδάργυρο την άνοδο. Το συμβατικό ρεύμα ρέει έξω από τη συσκευή στο χάλκινο τερματικό, έτσι ώστε ο χαλκός να είναι η κάθοδος. Κάθε φορά που μια συσκευή λειτουργεί χρησιμοποιώντας αντιδράσεις οξειδοαναγωγής, το τερματικό όπου συμβαίνει η οξείδωση είναι η άνοδος και το ηλεκτρόδιο όπου συμβαίνει η αναγωγή είναι η κάθοδος. Αυτό συμφωνεί με την παραπάνω περιγραφή:ο ψευδάργυρος (η άνοδος) οξειδώνεται και ο χαλκός (η κάθοδος) ανάγεται.
Ηλεκτρολυτικά κύτταρα
Στα ηλεκτρολυτικά στοιχεία, χρησιμοποιείται τροφοδοτικό για τη δημιουργία ρεύματος σε υγρό που περιέχει ιόντα. Για παράδειγμα, θα δούμε τι συμβαίνει όταν δύο ηλεκτρόδια τοποθετούνται σε ένα δείγμα λιωμένου χλωριούχο νάτριο (NaCl ή κοινό άλας).
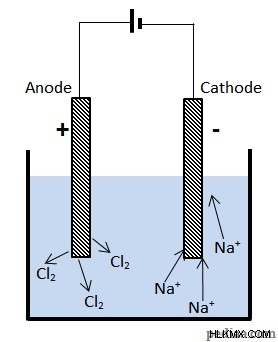
Ηλεκτρόλυση τετηγμένου χλωριούχου νατρίου
Το ηλεκτρόδιο που είναι συνδεδεμένο στον θετικό πόλο της μπαταρίας έλκει το  ανιόντα. Εδώ, αυτά τα ιόντα εκπέμπουν τα ηλεκτρόνια τους, σχηματίζοντας αέριο χλώριο.
ανιόντα. Εδώ, αυτά τα ιόντα εκπέμπουν τα ηλεκτρόνια τους, σχηματίζοντας αέριο χλώριο.

Στο ηλεκτρόδιο που είναι συνδεδεμένο με τον αρνητικό ακροδέκτη, τα θετικά ιόντα νατρίου αποκτούν ηλεκτρόνια, σχηματίζοντας άτομα νατρίου:

Εδώ, ο ακροδέκτης που αντλεί ρεύμα στη συσκευή είναι το ηλεκτρόδιο που είναι συνδεδεμένο στον θετικό πόλο της μπαταρίας. Επομένως, αυτή είναι η άνοδος.  ιόντα χάνουν τα ηλεκτρόνια τους εδώ, επομένως αυτό είναι σύμφωνο με την ιδέα ότι η οξείδωση συμβαίνει στην άνοδο. Το νάτριο σχηματίζεται στο άλλο ηλεκτρόδιο όπου
ιόντα χάνουν τα ηλεκτρόνια τους εδώ, επομένως αυτό είναι σύμφωνο με την ιδέα ότι η οξείδωση συμβαίνει στην άνοδο. Το νάτριο σχηματίζεται στο άλλο ηλεκτρόδιο όπου  τα ιόντα μειώνονται. Οι τρέχουσες ροές έξω της συσκευής από αυτό το τερματικό. Επομένως, αυτό το τερματικό σχηματίζει την κάθοδο.
τα ιόντα μειώνονται. Οι τρέχουσες ροές έξω της συσκευής από αυτό το τερματικό. Επομένως, αυτό το τερματικό σχηματίζει την κάθοδο.
Τα παραπάνω δύο παραδείγματα θα πρέπει να διευκρινίσουν ότι οι όροι άνοδος και κάθοδος δεν αναφέρεστε σε ένα συγκεκριμένο δυναμικό, αλλά μάλλον στο πώς ρέει το ρεύμα στη ρύθμιση. Για παράδειγμα, το "θετικό" ηλεκτρόδιο στο γαλβανικό στοιχείο είναι η "κάθοδός του", αλλά το "θετικό" ηλεκτρόδιο στην περίπτωση ηλεκτρόλυσης είναι η «άνοδος» του.
Διαφορά μεταξύ ανόδου και καθόδου
Τα ονόματα "άνοδος" και "κάθοδος" μπορούν να δοθούν σε ένα τερματικό ανάλογα με το εάν το ρεύμα ρέει σε αυτό το τερματικό από έξω ή εάν το ρεύμα ρέει από το τερματικό προς τα έξω . Ωστόσο, επειδή ο τρόπος με τον οποίο ρέουν τα ρεύματα σε διαφορετικές καταστάσεις μπορεί να είναι ριζικά διαφορετικός, η μετάφραση της χρήσης αυτών των όρων από τη μια κατάσταση στην άλλη θα μπορούσε να προκαλέσει σύγχυση. Επομένως, μπορεί να είναι απαραίτητο να εξεταστεί πρώτα η κατάσταση για να χρησιμοποιηθεί σωστά η ορολογία. Εάν είναι δυνατόν, θα πρέπει να χρησιμοποιούνται εναλλακτικοί, λιγότερο διφορούμενοι όροι (ανάλογα με την περίπτωση). Έχουμε συζητήσει δύο συγκεκριμένα παραδείγματα από την ηλεκτροχημεία, αλλά οι όροι "άνοδος" και "κάθοδος" χρησιμοποιούνται επίσης σε πολλά άλλα πεδία. Μερικά ακόμη παραδείγματα αναφέρονται στην ενότητα σύνοψης παρακάτω.
Τρέχουσα κατεύθυνση ροής:
Γενικά, το ρεύμα ρέει στην άνοδο Απο έξω.
Κάθοδος δίνει ρεύμα έξω από τη συσκευή. Αυτό σημαίνει ότι εκτός τη συσκευή, ηλεκτρόνια ροή από άνοδο σε κάθοδο.
Αντίδραση οξειδοαναγωγής:
Σε συσκευές που βασίζονται σε αντιδράσεις οξειδοαναγωγής, η οξείδωση λαμβάνει χώρα στις άνοδοι.
Ενώ η αναγωγή πραγματοποιείται σε κάθοδοι .
Σε γαλβανικά και ηλεκτρολυτικά κύτταρα:
Στα γαλβανικά κύτταρα και στα ηλεκτρολυτικά στοιχεία, ηκάθοδος προσελκύει κατιόντα και τα οξειδώνει.
Η άνοδος προσελκύει ανιόντα και τα μειώνει.
Στην Ηλεκτρόλυση:
Η άνοδος σχηματίζει το θετικό τερματικό στην ηλεκτρόλυση
Ενώ, ηκάθοδος σχηματίζει το αρνητικό τερματικό στο γαλβανικό στοιχείο.
Σε όπλα ηλεκτρονίων και σωλήνες ακτίνων Χ:
Σε πιστόλια ηλεκτρονίων και σωλήνες ακτίνων Χ, το τμήμα που εκπέμπει ηλεκτρόνια στη συσκευή σχηματίζει την κάθοδο .
Μέσα στη συσκευή, η άνοδος συλλέγει τα ηλεκτρόνια.
Όταν οι κανονικές δίοδοι συνδέονται σε μπροστινή πόλωση, η άνοδος είναι η p- πλευρά , η οποία είναι η πλευρά που συνδέεται με τη θετική πλευρά της μπαταρίας (τραβάει ρεύμα από το κελί). Ομοίως, ηκάθοδος σχηματίζει το n- πλευρά .
Παρόλο που τα ονόματα των τερματικών θα πρέπει να αντιστρέφονται όταν το ρεύμα ρέει με αντίστροφη πόλωση σε μια δίοδο Zener, η πλευρά p είναι ακόμα αναφέρεται ως «άνοδος ” παρόλο που τεχνικά δίνει ρεύμα προς τα έξω. Αυτή είναι μια αξιοσημείωτη εξαίρεση και υπογραμμίζει γιατί οι όροι "άνοδος" και "κάθοδος" πρέπει να αποφεύγονται, όταν είναι δυνατόν (σε αυτήν την περίπτωση, είναι προτιμότερο να αναφερόμαστε στις πλευρές ως p- πλευρά και το n- πλευρά).
Μια άλλη πηγή σύγχυσης προκύπτει όταν οι κατασκευαστές μπαταριών επισημαίνουν τον αρνητικό πόλο ενός επαναφορτιζόμενου μπαταρία ως «άνοδος ". Όταν η μπαταρία αποφορτίζεται, η ορολογία λειτουργεί. Ωστόσο, όταν η μπαταρία φορτίζεται, τεχνικά, η ορολογία θα πρέπει επίσης να αντιστραφεί.
Παραπομπές:
Denker, J. (2004). Πώς να ορίσετε την άνοδο και την κάθοδο . Ανακτήθηκε την 1η Οκτωβρίου 2015, από το Welcome to Av8n.com




