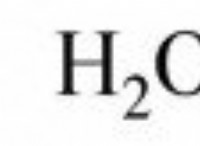Τι είναι συνήθως η οξείδωση ενός ατόμου οξυγόνου;
Εδώ είναι γιατί:
* Ηλεκτροργατιστικότητα: Το οξυγόνο είναι εξαιρετικά ηλεκτροαρνητικό, που σημαίνει ότι έχει έντονη τάση να προσελκύει ηλεκτρόνια.
* ηλεκτρόνια σθένους: Το οξυγόνο διαθέτει έξι ηλεκτρόνια σθένους και χρειάζεται δύο ακόμη για να επιτύχει ένα σταθερό οκτάτο.
* δεσμός: Το οξυγόνο τυπικά σχηματίζει δύο ομοιοπολικούς δεσμούς με άλλα άτομα, κερδίζοντας ένα ηλεκτρόνιο από κάθε δεσμό.
Εξαιρέσεις από τον κανόνα -2:
* υπεροξείδια: Σε υπεροξείδια (όπως το υπεροξείδιο του υδρογόνου, H₂O₂), κάθε άτομο οξυγόνου έχει κατάσταση οξείδωσης -1.
* υπεροξείδια: Σε υπεροξείδια (όπως το υπεροξείδιο του καλίου, KO₂), κάθε άτομο οξυγόνου έχει κατάσταση οξείδωσης -1/2.
* οξυγόνο σε στοιχειακή μορφή: Το οξυγόνο στη στοιχειακή του μορφή (O₂) έχει κατάσταση οξείδωσης 0.
* ενώσεις με φθόριο: Σε ενώσεις με φθόριο (το πιο ηλεκτροαρνητικό στοιχείο), το οξυγόνο μπορεί να έχει θετική κατάσταση οξείδωσης. Για παράδειγμα, σε διφθορίδη οξυγόνου (Of₂), το οξυγόνο έχει κατάσταση οξείδωσης +2.
Ωστόσο, στις περισσότερες ενώσεις, το οξυγόνο θα έχει κατάσταση οξείδωσης -2.