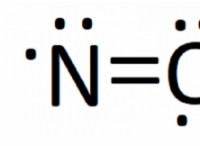Πώς η ιοντική ένωση λαμβάνει σταθερή διαμόρφωση ηλεκτρονίων;
Δείτε πώς λειτουργεί:
1. Μέταλλα τείνουν να χάσουν ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων, που συνήθως μοιάζουν με τη διαμόρφωση του ευγενούς αερίου στην προηγούμενη περίοδο. Αυτό έχει ως αποτέλεσμα το σχηματισμό κατιόντων , θετικά φορτισμένα ιόντα.
2. Μη Μέταλλα τείνουν να κερδίζουν ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων, που συνήθως μοιάζουν με τη διαμόρφωση του ευγενή αερίου την ίδια περίοδο. Αυτό έχει ως αποτέλεσμα το σχηματισμό Anions , αρνητικά φορτισμένα ιόντα.
Παράδειγμα:
Εξετάστε το σχηματισμό χλωριούχου νατρίου (NaCl):
* νάτριο (na) , ένα μέταλλο, έχει ένα ηλεκτρόνιο στο εξωτερικό του κέλυφος. Χάνει αυτό το ηλεκτρόνιο για να επιτύχει μια σταθερή διαμόρφωση ηλεκτρονίων που μοιάζει με νέον (NE), το οποίο έχει ένα πλήρες εξωτερικό κέλυφος 8 ηλεκτρονίων. Αυτό έχει ως αποτέλεσμα το σχηματισμό κατιόντος νατρίου (Na⁺).
* χλώριο (cl) , ένα μη μέταλλο, έχει 7 ηλεκτρόνια στο εξωτερικό κέλυφος του. Κερδίζει ένα ηλεκτρόνιο για να επιτύχει μια σταθερή διαμόρφωση ηλεκτρονίων που μοιάζει με αργόν (AR), η οποία έχει επίσης ένα πλήρες εξωτερικό κέλυφος 8 ηλεκτρονίων. Αυτό έχει ως αποτέλεσμα το σχηματισμό ενός χλωριούχου ανιόντος (CL⁻).
Η ηλεκτροστατική έλξη μεταξύ του θετικά φορτισμένου κατιόντος νατρίου και του αρνητικού φορτισμένου χλωριούχου ανιόντων σχηματίζει έναν ιοντικό δεσμό, με αποτέλεσμα τον σχηματισμό χλωριούχου νατρίου (NaCl).
Βασικά σημεία:
* Οι ιοντικές ενώσεις σχηματίζονται μεταξύ μετάλλων και μη μεταλλικών.
* Τα μέταλλα χάνουν ηλεκτρόνια για να γίνουν κατιόντα.
* Τα μη μέταλλα κερδίζουν ηλεκτρόνια για να γίνουν ανιόντα.
* Η ηλεκτροστατική έλξη μεταξύ κατιόντων και ανιόντων συγκρατεί την ιοντική ένωση μαζί.
* Η προκύπτουσα ένωση έχει ένα ουδέτερο συνολικό φορτίο, καθώς τα θετικά και αρνητικά φορτία εξισορροπούν.
Με τη μεταφορά ηλεκτρόνων και τη διαμόρφωση ιόντων, οι ιοντικές ενώσεις επιτυγχάνουν σταθερή διαμόρφωση ηλεκτρονίων, η οποία αποτελεί βασικό παράγοντα για τη σταθερότητα και τις χημικές τους ιδιότητες.