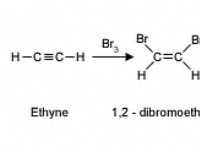
Ποιες είναι οι πρωταρχικές δυνάμεις έλξης μεταξύ των μορίων νερού στο H2O;
Εδώ είναι γιατί:
* πολικότητα: Τα μόρια του νερού είναι πολικά, που σημαίνει ότι έχουν θετικό και αρνητικό τέλος λόγω της ανομοιογενούς κοινής χρήσης των ηλεκτρονίων μεταξύ των ατόμων οξυγόνου και υδρογόνου. Το οξυγόνο είναι πιο ηλεκτροαρνητικό, τραβώντας ηλεκτρόνια προς τον εαυτό του, δημιουργώντας ένα μερικό αρνητικό φορτίο στο άτομο οξυγόνου και ένα μερικό θετικό φορτίο στα άτομα υδρογόνου.
* δεσμός υδρογόνου: Τα μερικώς θετικά άτομα υδρογόνου ενός μορίου νερού προσελκύονται από το μερικώς αρνητικό άτομο οξυγόνου ενός άλλου μορίου νερού. Αυτή η ισχυρή αλληλεπίδραση διπολικού-δίπολου ονομάζεται δεσμός υδρογόνου.
Άλλες δυνάμεις έλξης:
Ενώ οι δεσμοί υδρογόνου είναι τα ισχυρότερα και πιο σημαντικά, τα μόρια του νερού αντιμετωπίζουν επίσης ασθενέστερες δυνάμεις έλξης, όπως:
* Δυνάμεις διασποράς του Λονδίνου: Αυτά είναι προσωρινά, αδύναμα αξιοθέατα που προκύπτουν από προσωρινές διακυμάνσεις στην κατανομή ηλεκτρονίων.
* αλληλεπιδράσεις διπόλης-διπόλης: Αν και ασθενέστεροι από τους δεσμούς υδρογόνου, αυτές οι δυνάμεις εμφανίζονται μεταξύ πολικών μορίων λόγω των μόνιμων διπόλων.
Σημασία της σύνδεσης υδρογόνου:
Οι δεσμοί υδρογόνου είναι υπεύθυνοι για πολλές από τις μοναδικές ιδιότητες του νερού, όπως:
* Υψηλό σημείο βρασμού: Οι ισχυροί δεσμοί υδρογόνου απαιτούν πολλή ενέργεια για να σπάσουν, οδηγώντας σε σχετικά υψηλό σημείο βρασμού του νερού.
* Υψηλή επιφανειακή τάση: Η ισχυρή έλξη μεταξύ των μορίων του νερού στην επιφάνεια δημιουργεί μια ισχυρή επιφανειακή τάση, επιτρέποντας στο νερό να σχηματίσει σταγονίδια.
* καλός διαλύτης: Η πολικότητα και η ικανότητα του νερού να σχηματίσουν δεσμούς υδρογόνου το καθιστούν εξαιρετικό διαλύτη για πολλά πολικά μόρια.
Συνοπτικά, οι δεσμοί υδρογόνου είναι οι πρωταρχικές δυνάμεις της έλξης μεταξύ των μορίων του νερού, υπεύθυνες για πολλές από τις βασικές ιδιότητες του νερού.