Προσρόφηση vs Απορρόφηση – Διαφορές και Παραδείγματα
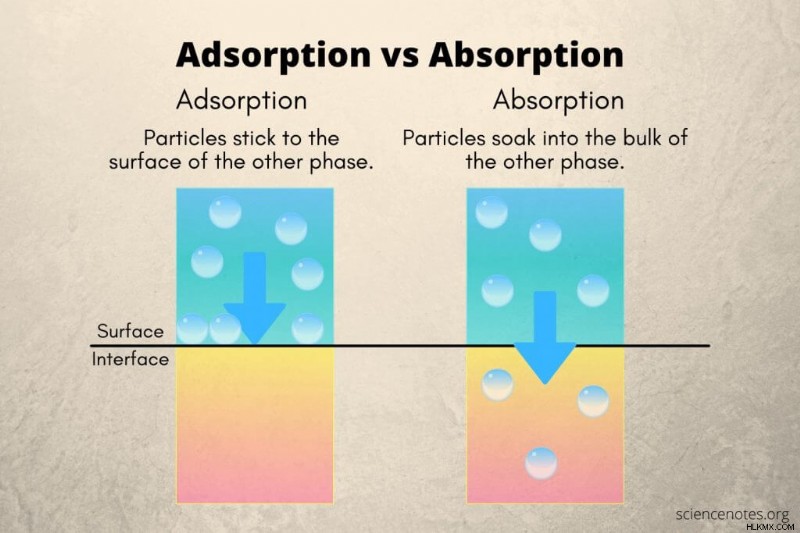
Η προσρόφηση και η απορρόφηση είναι δύο διαδικασίες προσρόφησης μέσω των οποίων μια ουσία προσκολλάται σε μια άλλη. Η κύρια διαφορά μεταξύ τους είναι ότι η προσρόφηση είναι η προσκόλληση σωματιδίων σε μια ουσία, ενώ η απορρόφηση περιλαμβάνει μεταφορά μάζας σε άλλο υλικό. Όμως, η προσρόφηση και η απορρόφηση περιλαμβάνουν και άλλες διαφορές.
Ακολουθεί μια σύγκριση της προσρόφησης και της απορρόφησης, μια πιο προσεκτική ματιά στους ορισμούς τους και παραδείγματα για κάθε διαδικασία.
Σύγκριση Προσρόφησης έναντι Απορρόφησης
Συνήθως, όταν οι άνθρωποι σκέφτονται την προσρόφηση και την απορρόφηση, εξετάζουν τη μεταφορά μάζας υγρών σωματιδίων σε (προσρόφηση) ή σε στερεά (απορρόφηση). Όμως, αυτές οι διεργασίες μπορεί να περιλαμβάνουν πλάσμα, αέρια, υγρά ή διαλυμένα στερεά όπου τα ιόντα, τα άτομα ή τα μόρια απορροφώνται ή απορροφώνται από υγρά ή στερεά. Ενώ και οι δύο διαδικασίες ρόφησης μοιράζονται αυτήν την ομοιότητα, διαφέρουν με διάφορους τρόπους:
| Απορρόφηση | Απορρόφηση |
|---|---|
| Συσσώρευση σωματιδίων σε μια επιφάνεια ουσίας | Συσσώρευση σωματιδίων σε μια άλλη ουσία |
| Επιφανειακό φαινόμενο | Μαζικό φαινόμενο |
| Εξώθερμη διεργασία | Ενδόθερμη διεργασία |
| Ευνοείται από τη μείωση της θερμοκρασίας | Δεν επηρεάζεται από τη θερμοκρασία |
| Το ποσοστό αυξάνεται σταθερά μέχρι να φτάσει σε ισορροπία | Εμφανίζεται με ομοιόμορφο ρυθμό |
| Η συγκέντρωση στην επιφάνεια διαφέρει από την εσωτερική συγκέντρωση | Η συγκέντρωση γίνεται τελικά η ίδια σε όλο το υλικό |
Ορισμός και παραδείγματα προσρόφησης
Απορρόφηση εμφανίζεται όταν ιόντα, άτομα ή μόρια προσκολλώνται σε μια επιφάνεια. Η ουσία που προσροφάται στην επιφάνεια ονομάζεται προσροφητικό . Η ουσία με την επιφάνεια ονομάζεται προσροφητικό . Η προσρόφηση είναι μια εξώθερμη διαδικασία επειδή απελευθερώνεται ενέργεια όταν το προσροφητικό κολλάει στο προσροφητικό. Ο ρυθμός της διαδικασίας εξαρτάται σε μεγάλο βαθμό από την επιφάνεια και τη θερμοκρασία. Η χαμηλή θερμοκρασία προάγει την προσρόφηση επειδή τα σωματίδια με λιγότερη θερμική ενέργεια έχουν λιγότερη κινητική ενέργεια και είναι πιο πιθανό να κολλήσουν σε επιφάνειες από σχηματισμό ομοιοπολικού δεσμού, δεσμούς υδρογόνου ή άλλες διαμοριακές δυνάμεις.
Παραδείγματα προσρόφησης περιλαμβάνουν:
- Απορρόφηση νερού σε silica gel
- Μολυσματικές ουσίες που προσροφούνται σε ενεργό άνθρακα
- Σωματίδια που προσροφούνται σε ζεόλιθους
- Το ασήμι προσκολλάται στο γυαλί και σχηματίζει επιφάνεια καθρέφτη
- Αντικολλητικές επικαλύψεις σε τηγάνια
- Ψυκτικά συγκροτήματα προσρόφησης που χρησιμοποιούνται με ψυκτικά μέσα
- Οι ιοί προσροφούνται σε κύτταρα και επιφάνειες
Οι χρήσεις της προσρόφησης περιλαμβάνουν τον καθαρισμό του νερού, το νερό ψύξης για κλιματιστικά, τους ετερογενείς καταλύτες, τις επιφανειακές επεξεργασίες και τις στήλες ανταλλαγής ιόντων.
Ορισμός και παραδείγματα απορρόφησης
Απορρόφηση εμφανίζεται όταν ιόντα, άτομα ή μόρια περνούν σε ένα ογκώδες υλικό. Αυτά τα σωματίδια (το απορροφούν ) διαχέεται ή διαλύεται στο απορροφητικό ουσία. Ένα γνωστό παράδειγμα είναι μια χαρτοπετσέτα που μαζεύει νερό. Τελικά, το νερό διαπερνά ομοιόμορφα το χαρτί. Η απορρόφηση συμβαίνει παθητικά (διάχυση) ή ενεργητικά (διευκολυνόμενη διάχυση ή ενεργητική μεταφορά) και είναι μια ενδόθερμη διαδικασία. Ο ρυθμός απορρόφησης εξαρτάται από διάφορους παράγοντες, όπως η συγκέντρωση, η εκτεθειμένη επιφάνεια και η πίεση.
Παραδείγματα απορρόφησης περιλαμβάνουν:
- Μια χαρτοπετσέτα που απορροφά νερό
- Νερό που απορροφά τα μαλλιά
- Οξυγόνο από τον αέρα που διαλύεται στο νερό
- Το υδροξείδιο του νατρίου απορροφά το διοξείδιο του άνθρακα από τον αέρα
- Τα κύτταρα απορροφούν νερό και θρεπτικά συστατικά από το περιβάλλον τους
Οι χρήσεις της απορρόφησης περιλαμβάνουν τον καθαρισμό της διαρροής, την ενυδάτωση και την πέψη.
Σημειώστε ότι υπάρχει ένας άλλος ορισμός της απορρόφησης στην επιστήμη, που αναφέρεται στην αλληλεπίδραση όπου η ύλη απορροφά ενέργεια από το φως.
Αναφορές
- Crini, Grégorio; Badot, Pierre-Marie (2010). Διαδικασίες ρόφησης και ρύπανση :συμβατικοί και μη συμβατικοί ροφητές για την απομάκρυνση ρύπων από τα λύματα . Μπεζανσόν:Presses universitaires de Franche-Comté. ISBN 978-2848673042.
- Cussler, Ε. L. (1997). Diffusion:Mass Transfer in Fluid Systems (2η έκδ.). Νέα Υόρκη:Cambridge University Press. ISBN 978-0-521-45078-2.
- IUPAC (1997). Σύνοψη Χημικής Ορολογίας (το «Χρυσό Βιβλίο»). Επιστημονικές Εκδόσεις Blackwell. doi:10.1351/goldbook
- McMurry, John (2003). Βασικές αρχές της Οργανικής Χημείας (5η έκδ.). Άγκνους ΜακΝτόναλντ. ISBN 0-534-39573-2.




