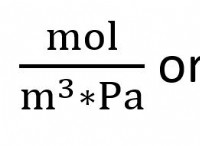Τι είναι το KEQ για την αντίδραση H2 (G) συν CL2 (G) 2HCL (G);
Εδώ είναι γιατί:
* Η αντίδραση είναι εξαιρετικά εξωθερμική: Ο σχηματισμός του HCL απελευθερώνει σημαντική ποσότητα θερμότητας, καθιστώντας τη θερμοδυναμικά ευνοϊκή.
* Το HCl είναι ένα πολύ σταθερό μόριο: Ο δεσμός μεταξύ υδρογόνου και χλωρίου είναι πολύ ισχυρός, συμβάλλοντας στη σταθερότητα του προϊόντος.
Ωστόσο, η παροχή μιας συγκεκριμένης αριθμητικής τιμής για το KEQ απαιτεί περισσότερες πληροφορίες:
* Θερμοκρασία: Η σταθερά ισορροπίας (KEQ) εξαρτάται από τη θερμοκρασία. Μια υψηλότερη θερμοκρασία θα μετατοπίζει γενικά την ισορροπία προς τα αντιδραστήρια (H2 και CL2), καθιστώντας το KEQ μικρότερο.
* Πίεση: Αν και δεν είναι τόσο σημαντική όσο η θερμοκρασία, η πίεση μπορεί επίσης να επηρεάσει τη θέση ισορροπίας. Η αύξηση της πίεσης θα ευνοούσε την πλευρά με λιγότερες γραμμομονείς αερίου (στην περίπτωση αυτή, την πλευρά του προϊόντος).
Επομένως, για να αποκτήσετε μια ακριβή τιμή για το KEQ, θα πρέπει να καθορίσετε τη θερμοκρασία και την πίεση στην οποία λαμβάνει χώρα η αντίδραση.
Σημείωση: Η αντίδραση μεταξύ υδρογόνου και χλωρίου είναι εξαιρετικά εκρηκτική και δεν πρέπει να επιχειρείται χωρίς κατάλληλες προφυλάξεις ασφαλείας και καθοδήγηση εμπειρογνωμόνων.