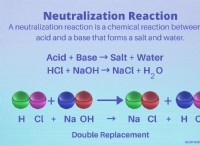
Στην αναπαράσταση μιας χημικής αντίδρασης, τι σημαίνει το Arrow;
Εδώ είναι μια κατανομή:
* Μονό βέλος (→): Αυτό υποδεικνύει μια αντίδραση που προχωράει προς μία κατεύθυνση μόνο, πράγμα που σημαίνει ότι τα αντιδραστήρια μετατρέπονται σε προϊόντα και η αντίδραση δεν επιστρέφει στα αντιδραστήρια. Αυτό ονομάζεται μη αναστρέψιμη αντίδραση .
* Διπλό βέλος (⇌): Αυτό υποδεικνύει μια αντίδραση που προχωρά και προς τις δύο κατευθύνσεις, που σημαίνει ότι τα αντιδραστήρια σχηματίζουν προϊόντα και τα προϊόντα μπορούν επίσης να αντιδράσουν για να σχηματίσουν τα αντιδραστήρια. Αυτό ονομάζεται a αναστρέψιμη αντίδραση .
Παράδειγμα:
* μη αναστρέψιμο: A + b → c + d (a και b αντιδρούν στη μορφή c και d, αλλά c και d δεν αντιδρούν πίσω στη μορφή a και b)
* αναστρέψιμο: A + b ⇌ c + d (a και b αντιδρούν στη μορφή c και d, και c και d μπορούν να αντιδράσουν για να σχηματίσουν a και b)
Σημείωση: Παρόλο που μια αντίδραση αντιπροσωπεύεται με διπλό βέλος, αυτό δεν σημαίνει απαραίτητα ότι η αντίδραση είναι σε ισορροπία. Η ισορροπία σημαίνει ότι οι τιμές προς τα εμπρός και αντίστροφα είναι ίσα.