Τι είναι τα διατομικά μόρια;
Τα διατομικά μόρια είναι μόρια με δύο άτομα στη δομή τους. Αυτό μπορεί να είναι δύο άτομα συνδεδεμένα σε έναν πυρήνα ή δύο άτομα συνδεδεμένα σε περισσότερους από έναν πυρήνες (ετεροπύρηνα).
Ο κόσμος των πολύ μικροσκοπικών υπαγορεύει τα χαρακτηριστικά που παρουσιάζει ο κόσμος των πολύ μεγάλων εκθεμάτων. Αυτός ο «κόσμος των μικρών» κατοικείται από ατομικά και υποατομικά σωματίδια.
Τα άτομα μπορούν να θεωρηθούν σαν μπλοκ Lego. συνδυάζονται με διαφορετικούς τρόπους για να κάνουν διαφορετικά πράγματα. Έτσι, τα ίδια μπλοκ Lego μπορούν να φτιάξουν μια βάρκα ή μια γέφυρα, όπως τα άτομα που μπορούν να κάνουν μια λεπίδα γρασιδιού ή μια καμηλοπάρδαλη.
Τα άτομα συνδέονται για να δημιουργήσουν μόρια. (Φωτογραφία :Vitalii Barida/ Shutterstock)
Όταν δύο ή περισσότερα άτομα ενώνονται, σχηματίζουν ένα μόριο. Ο αριθμός των ατόμων σε ένα μόριο υποδηλώνει το πρόθεμα, επομένως ένα μόριο που περιέχει δύο άτομα ονομάζεται διατομικό.
Υπάρχουν διάφοροι τύποι διατομικών μορίων. Ας ξεκινήσουμε αυτή τη συζήτηση κατανοώντας καλύτερα τη λειτουργία ενός μορίου.
Μόρια
Τα μόρια είναι τα συστατικά της ύλης. είναι τα μικρότερα σωματίδια που εμφανίζουν τις χημικές ιδιότητες του στοιχείου στο οποίο ανήκουν. Τα μόρια μπορεί να είναι ομοπυρηνικά, που σημαίνει ότι μπορούν να αποτελούνται από άτομα από ένα μόνο χημικό στοιχείο (π.χ. Υδρογόνο (Η2)), ή μπορεί να είναι ετεροπυρηνικά, που σημαίνει ότι μπορεί να είναι μια χημική ένωση με άτομα από περισσότερα από ένα στοιχεία (π.χ., νερό ( H2O)).
Τα μόρια σχηματίζονται όταν δύο ή περισσότερα άτομα συγκρατούνται μεταξύ τους με χημικούς δεσμούς. Αυτός ο δεσμός αντιπροσωπεύει μια διαρκή έλξη μεταξύ μορίων, ιόντων και ατόμων. Αυτός ο δεσμός μπορεί να είναι αποτέλεσμα της έλξης αντίθετα φορτισμένων ιόντων ή της κοινής χρήσης ηλεκτρονίων μεταξύ δύο ατόμων.
Τα άτομα είναι σταθερά εάν η εξωτερική τους στιβάδα είναι είτε γεμάτη είτε άδεια. Για να θεωρηθεί γεμάτο, χρειάζεται να έχει 8 ηλεκτρόνια στο εξωτερικό στρώμα, το οποίο ονομάζεται οκτάδα. Όταν δεν συμβαίνει αυτό, τα άτομα συνδέονται είτε αποκτούν είτε χάνουν ένα ηλεκτρόνιο από άλλο άτομο ή μοιράζονται ζεύγη ηλεκτρονίων με άλλο άτομο.
Αυτή η συναλλαγή ηλεκτρονίων δίνει τη θέση της σε χημικούς δεσμούς:
Ιωνικός δεσμός
Αυτός ο δεσμός συμβαίνει όταν υπάρχει μια συνολική μεταφορά ηλεκτρονίων από το ένα άτομο στο άλλο. Αυτό έχει ως αποτέλεσμα δύο ιόντα, τα άτομα που έχουν αποκτήσει ένα ή περισσότερα ηλεκτρόνια ονομάζονται ανιόντα (αρνητικά φορτισμένα) και αυτά που έχουν χάσει ένα ή περισσότερα ηλεκτρόνια ονομάζονται κατιόντα (θετικά φορτισμένα).
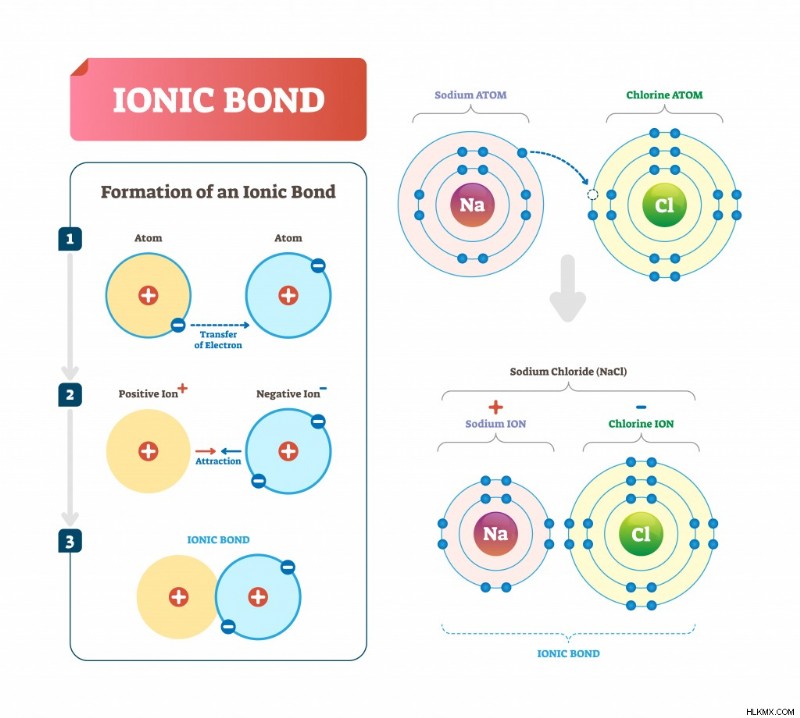
Λειτουργίες ιοντικού δεσμού σε NaCl. (Φωτογραφία:VectorMine/ Shutterstock)
Πάρτε την περίπτωση του NaCl (επιτραπέζιο αλάτι). Το χλώριο περιέχει 7 ηλεκτρόνια στο εξωτερικό του περίβλημα και χρειάζεται ένα για να ολοκληρώσει την οκτάδα του. Το νάτριο έχει 1 ηλεκτρόνιο στο εξωτερικό του περίβλημα, το οποίο δωρίζει στο χλώριο για να σχηματίσει έναν ιοντικό δεσμό.
Ομοιοπολικός δεσμός
Ένας ομοιοπολικός δεσμός προκύπτει όταν ζεύγη ηλεκτρονίων μοιράζονται μεταξύ δύο ατόμων. είναι επίσης ο ισχυρότερος από τους χημικούς δεσμούς. Αυτή η κοινή χρήση των ηλεκτρονίων βοηθά τα άτομα να φτάσουν στη σταθερή τους κατάσταση.
Υπάρχουν δύο κύριοι τύποι ομοιοπολικών δεσμών - μη πολικοί και πολικοί ομοιοπολικοί δεσμοί. Μη πολικοί ή καθαροί ομοιοπολικοί δεσμοί σχηματίζονται μεταξύ ατόμων που έχουν την ίδια ηλεκτραρνητικότητα και επομένως μοιράζονται εξίσου τα ηλεκτρόνια. Αυτό φαίνεται σε άτομα με διαφορά ηλεκτραρνητικότητας μικρότερη από 0,4.

Πολικοί και μη πολικοί ομοιοπολικοί δεσμοί. (Φωτογραφία:udaix/ Shutterstock)
Όταν η διαφορά ηλεκτραρνητικότητας είναι μεταξύ 0,4 και 1,7, ο δεσμός γίνεται πολικός. Σε αυτή την περίπτωση, τα ηλεκτρόνια περνούν περισσότερο χρόνο κατά μέσο όρο στο άτομο με μεγαλύτερη ηλεκτραρνητικότητα. Για παράδειγμα, στο νερό (H2O), τα ηλεκτρόνια είναι με οξυγόνο (O) τις περισσότερες φορές, κατά μέσο όρο, δίνοντάς του ένα μερικό αρνητικό φορτίο και δίνοντας στο υδρογόνο (H) ένα μερικό θετικό φορτίο.
Διατομικά μόρια
Τα μόρια με δύο άτομα του ίδιου ή διαφορετικών χημικών στοιχείων ονομάζονται διατομικά. Σχεδόν όλα τα διατομικά στοιχεία είναι αέρια σε θερμοκρασία δωματίου (π.χ. Υδρογόνο, Άζωτο). Ορισμένα στοιχεία γίνονται διατομικά σε υψηλότερες θερμοκρασίες.
Τα διατομικά μόρια αζώτου (78%) και οξυγόνου (21%) αποτελούν το μεγαλύτερο μέρος της ατμόσφαιρας της γης. Σε διαστρική κλίμακα, το διατομικό μόριο του υδρογόνου είναι το πιο άφθονο σε ολόκληρο το σύμπαν.
Τύποι διατομικών μορίων
Τα διατομικά μόρια μπορεί να είναι δύο άτομα που μοιράζονται έναν πυρήνα, τα οποία είναι συνήθως του ίδιου στοιχείου, ή δύο άτομα σε δύο πυρήνες δύο διαφορετικών στοιχείων.
Ομοπυρηνικά διατομικά μόρια
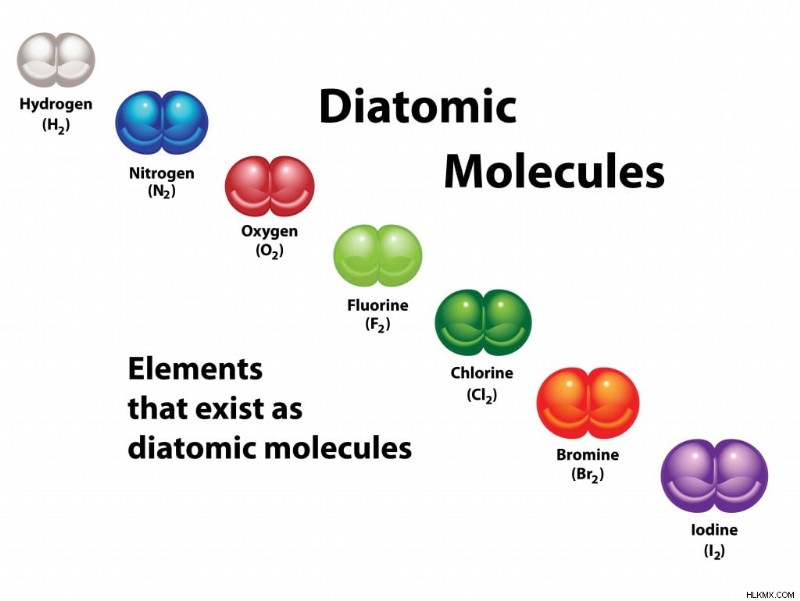
Ομοπυρηνικά διατομικά μόρια. (Φωτογραφία:OSweetNature/ Shutterstock)
Ομοπυρηνικά μόρια είναι εκείνα που αποτελούνται από άτομα ενός μόνο στοιχείου. Τα μόνα στοιχεία που σχηματίζουν διατομικά μόρια σε θερμοκρασία δωματίου είναι τα αέρια. Αυτά είναι:
Υδρογόνο – H2
Το υδρογόνο βρίσκεται σε αφθονία στη συνολική σύνθεση του σύμπαντος. Ένα άτομο υδρογόνου αποτελείται από ένα μόνο ηλεκτρόνιο σθένους στην εξωτερική του στιβάδα. Για να γίνει σταθερό, το άτομο υδρογόνου χρειάζεται ένα άλλο ηλεκτρόνιο για να ολοκληρώσει το στρώμα του. Αυτό γίνεται με την κοινή χρήση ενός πρωτονίου με ένα άλλο άτομο υδρογόνου μέσω ενός μη πολικού ομοιοπολικού δεσμού, καθιστώντας το έτσι ένα διατομικό μόριο.
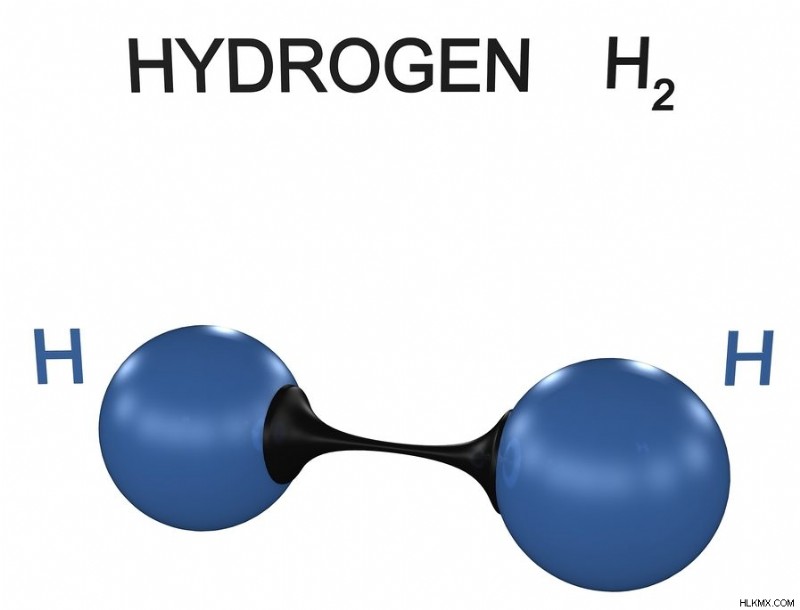
Μόριο υδρογόνου. (Φωτογραφία:ch123/ Shutterstock)
Άζωτο – N2
Το άζωτο είναι το πιο σημαντικό στοιχείο στην ατμόσφαιρα της Γης. Ένα άτομο αζώτου αποτελείται από 5 ηλεκτρόνια σθένους στο εξωτερικό στρώμα του. Για να γίνει μια σταθερή ένωση, δύο άτομα αζώτου ενώνονται και μοιράζονται τρία ηλεκτρόνια του αντίθετου ατόμου, αφήνοντας 8 ηλεκτρόνια στην τελευταία στιβάδα. Αυτό γίνεται ένα διατομικό μόριο αζώτου με μη πολικούς ομοιοπολικούς δεσμούς μεταξύ των δύο ατόμων.
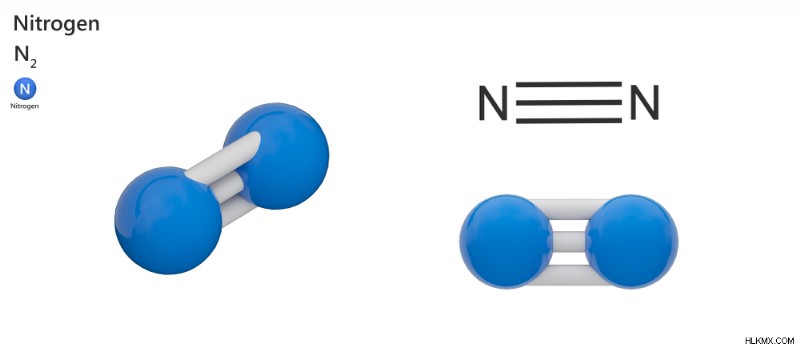
Μόριο αζώτου. (Φωτογραφία :Orange Deer studio/ Shutterstock)
Οξυγόνο – O2
Το οξυγόνο βρίσκεται εύκολα στην ατμόσφαιρα της γης, καθώς και στη συνολική σύνθεση του σύμπαντος. Ένα άτομο οξυγόνου αποτελείται από 6 ηλεκτρόνια σθένους στο εξωτερικό στρώμα του. Μοιράζεται δύο ηλεκτρόνια με ένα άλλο άτομο οξυγόνου μέσω ενός μη πολικού ομοιοπολικού δεσμού για να γίνει ένα σταθερό διατομικό μόριο.

Μόριο οξυγόνου. (Φωτογραφία :Orange Deer studio/ Shutterstock)
Φθόριο – F2
Το φθόριο είναι ένα εξαιρετικά τοξικό ωχρό αέριο με έντονη οσμή που υπάρχει ως διατομικό μόριο σε θερμοκρασία δωματίου. Το εξωτερικό περίβλημα σε ένα άτομο φθορίου περιέχει 7 ηλεκτρόνια σθένους. Μοιράζεται ένα ηλεκτρόνιο με ένα άλλο άτομο φθορίου μέσω ενός μη πολικού ομοιοπολικού δεσμού για να γίνει σταθερό και να σχηματίσει ένα διατομικό μόριο φθορίου.
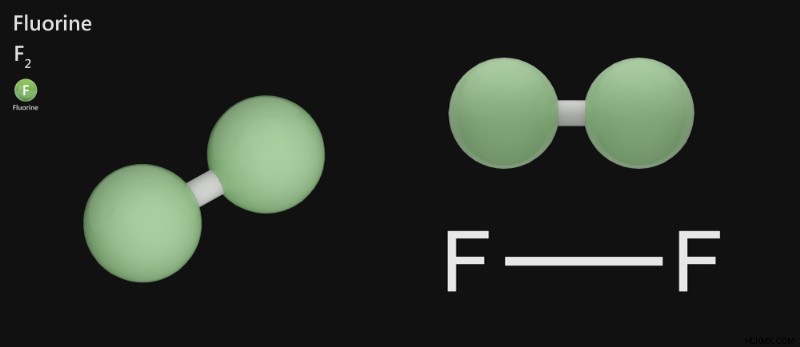
Μόριο φθορίου. (Φωτογραφία :Orange Deer studio/ Shutterstock)
Χλώριο – Cl2
Το χλώριο είναι ένα εξαιρετικά αντιδραστικό στοιχείο που έχει κιτρινοπράσινο χρώμα και υπάρχει ως αέριο σε θερμοκρασία δωματίου. Αποτελείται από 3 στοιβάδες ηλεκτρονίων και έχει 7 ηλεκτρόνια στο εξωτερικό στρώμα του. Μοιράζεται ένα ηλεκτρόνιο με ένα άλλο άτομο χλωρίου μέσω ενός μη πολικού ομοιοπολικού δεσμού για να σχηματίσει ένα σταθερό διατομικό μόριο χλωρίου.
Βρώμιο – Br2
Σε θερμοκρασία δωματίου, το βρώμιο είναι ένα κόκκινο-καφέ υγρό. Αυτό το στοιχείο σχηματίζει διατομικά μόρια όταν αυξάνεται η θερμοκρασία και γίνεται αέριο. Το πιο εξωτερικό στρώμα αποτελείται από 7 ηλεκτρόνια και χρειάζεται ένα για να γίνει σταθερό και να κάνει το Br2.
Ιώδιο – Ι2
Το ιώδιο υπάρχει ως πορφυρό-μαύρο μη μεταλλικό στερεό σε θερμοκρασία δωματίου. Παρόμοια με το βρώμιο, σχηματίζει ένα διατομικό μόριο I2 όταν θερμαίνεται. Ένα άτομο ιωδίου μοιράζεται ένα ηλεκτρόνιο με ένα άλλο άτομο για να συμπληρώσει την οκτάδα του και να γίνει σταθερό.
Ετεροπυρηνικά διατομικά μόρια
Τα άτομα που συνδυάζονται με άτομα άλλων στοιχείων για να γίνουν σταθερά και να δημιουργήσουν διατομικά μόρια είναι ετεροπυρηνικά. Πολλά στοιχεία μπορούν να συνδυαστούν για να σχηματίσουν αυτά τα ετεροπυρηνικά διατομικά μόρια, υπό την προϋπόθεση ότι υπάρχουν ευνοϊκές συνθήκες.
Μερικά παραδείγματα είναι:
Υδροχλώριο – HCL
Αυτό είναι ένα άχρωμο αέριο σε θερμοκρασία δωματίου και σχηματίζει λευκούς ατμούς (υδροχλωρικό οξύ) κατά την επαφή με την ατμόσφαιρα. Ένα άτομο υδρογόνου έχει ένα ηλεκτρόνιο στην πιο εξωτερική του στιβάδα και το χλώριο έχει 7, έτσι σχηματίζουν έναν ομοιοπολικό δεσμό για να ολοκληρώσουν την οκτάδα και να γίνουν ένα σταθερό διατομικό μόριο.
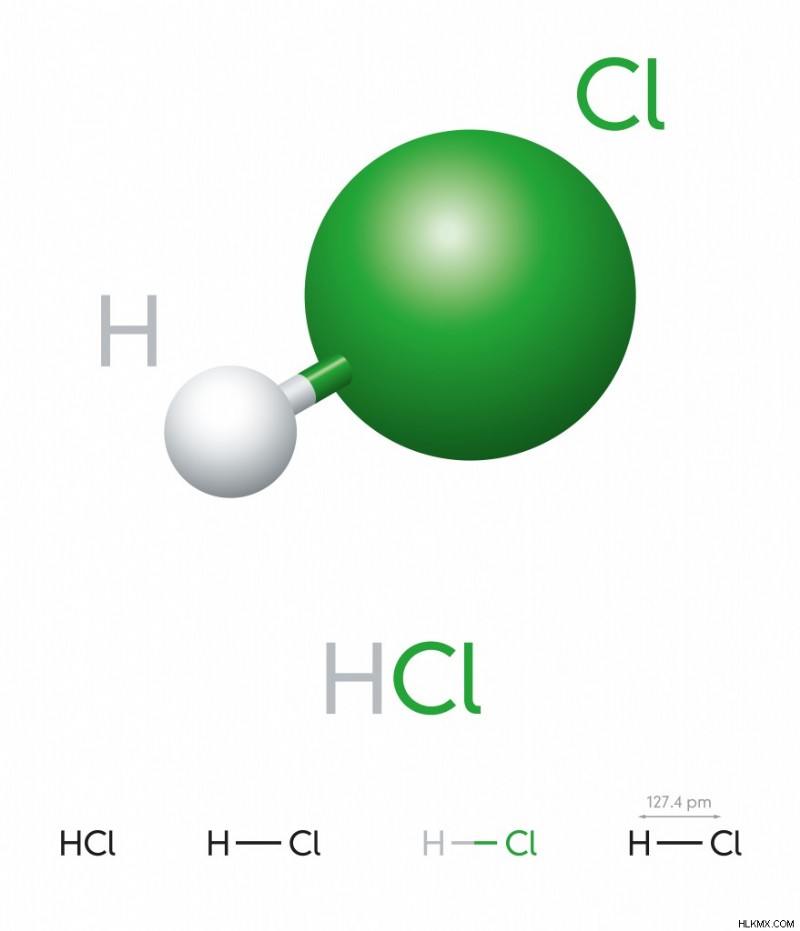
Diatomic HCL (Photo Credit :Peter Hermes Furian/ Shutterstock)
Μονοξείδιο του άνθρακα – CO
Το μονοξείδιο του άνθρακα είναι ένα εύφλεκτο αέριο που είναι άοσμο, άχρωμο και άγευστο. Είναι ελαφρώς λιγότερο πυκνό από τον αέρα. Ο άνθρακας έχει 4 και το οξυγόνο έχει 6 ηλεκτρόνια σθένους στο εξωτερικό στρώμα. Τα άτομα σχηματίζουν έναν τριπλό δεσμό για να γίνουν σταθερά και έτσι να γίνουν ένα ετεροπυρηνικό διατομικό μόριο.
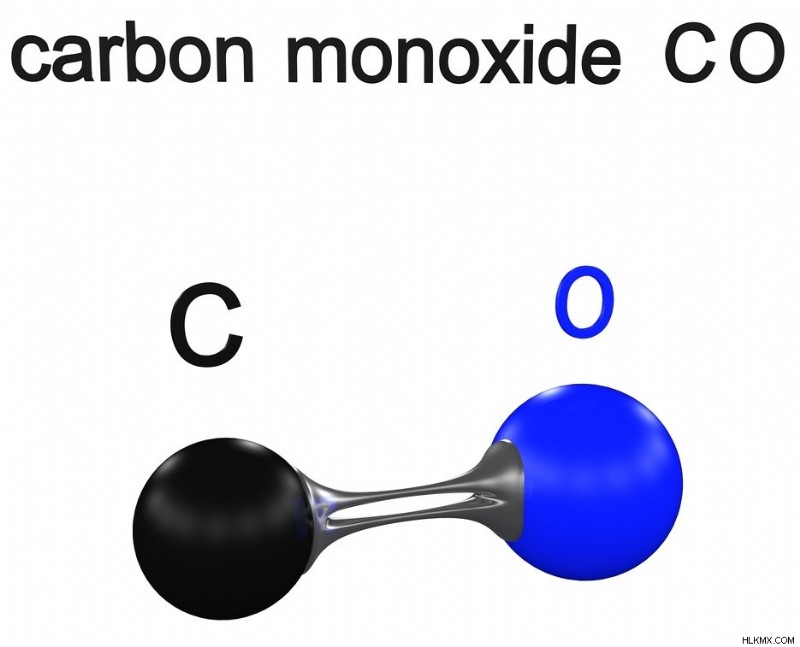
Διατομικό μονοξείδιο του άνθρακα. (Φωτογραφία:ch123/ Shutterstock)
Νιτρικό οξείδιο – ΟΧΙ
Το μονοξείδιο του αζώτου είναι ένα άχρωμο αέριο. Ένα άτομο αζώτου έχει 5 ηλεκτρόνια σθένους στην πιο εξωτερική στιβάδα και το οξυγόνο έχει 6, επομένως συνδέονται μεταξύ τους για να γίνουν σταθερά διατομικά μόρια. Ένα ηλεκτρόνιο παραμένει ασύζευκτο, γεγονός που καθιστά το μονοξείδιο του αζώτου μια ελεύθερη ρίζα.

Οξείδιο του αζώτου με ελεύθερη ρίζα. (Photo Credit :molekuul_be/ Shutterstock) (Photo Credit :molekuul_be/Shutterstock)
Κλείσιμο
Μερικά από τα πιο άφθονα και κοινά στοιχεία στον πλανήτη μας είναι τα διατομικά μόρια. Από τις κατηγορίες των ομοπύρηνων έως τις ετεροπυρηνικές, τα διατομικά μόρια αντιπροσωπεύουν μια σταθερή κατάσταση για τα στοιχεία λόγω των ισχυρών χημικών δεσμών που σχηματίζονται μεταξύ των ηλεκτρονίων σθένους.




