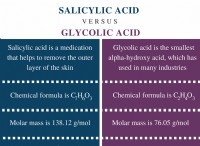
Εξίσωση συμβόλων για μέταλλα και οξέα;
Εξίσωση συμβόλων για μέταλλα και οξέα:
Η εξίσωση γενικού συμβόλου για την αντίδραση ενός μετάλλου με ένα οξύ είναι:
μέταλλο + οξύ → αλάτι + υδρογόνο
Παράδειγμα:
* Μαγνήσιο + υδροχλωρικό οξύ → Χλωρίδιο μαγνησίου + Αέριο υδρογόνο
Εξίσωση συμβόλων:
mg (s) + 2HCl (aq) → mgcl₂ (aq) + h₂ (g)
Επεξήγηση:
* μέταλλο: Το μέταλλο αντιπροσωπεύεται από το χημικό του σύμβολο (π.χ. Mg για μαγνήσιο).
* οξύ: Το οξύ αντιπροσωπεύεται από τον χημικό του τύπο (π.χ. HCl για υδροχλωρικό οξύ).
* αλάτι: Το άλας σχηματίζεται από το μεταλλικό κατιόν (θετικό ιόν) και το ανιόν (αρνητικό ιόν) από το οξύ. Ο χημικός τύπος του αλατιού προσδιορίζεται με εξισορρόπηση των φορτίων των ιόντων (π.χ. MgCl₂ για χλωριούχο μαγνήσιο).
* Αέριο υδρογόνου: Το αέριο υδρογόνου παράγεται ως υποπροϊόν της αντίδρασης. Αντιπροσωπεύεται από τον χημικό τύπο H₂.
Σημείωση: Δεν αντιδρούν όλα τα μέταλλα με όλα τα οξέα. Η αντιδραστικότητα ενός μετάλλου με ένα οξύ εξαρτάται από τη θέση του μετάλλου στη σειρά αντιδραστικότητας. Τα μέταλλα υψηλότερα στη σειρά αντιδραστικότητας αντιδρούν πιο εύκολα με τα οξέα.
Παραδείγματα άλλων αντιδράσεων μεταλλικού οξέος:
* ψευδάργυρο + θειικό οξύ → ψευδάργυρο + υδρογόνο αέριο
* zn (s) + h₂so₄ (aq) → ZnSo₄ (aq) + h₂ (g)
* Σίδερο + Υδροχλωρικό οξύ → Σίδερο (II) Χλωρίδιο + Αέριο υδρογόνου
* fe (s) + 2HCl (aq) → fecl₂ (aq) + h₂ (g)
Αυτή η γενική εξίσωση και τα παραδείγματα υπογραμμίζουν τα βασικά χαρακτηριστικά αυτής της αντίδρασης, αποδεικνύοντας το σχηματισμό ενός αέματος αλατιού και υδρογόνου.