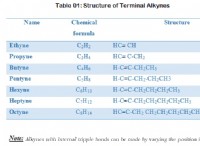
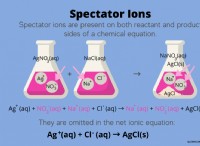
Πώς είναι οι τρεις ιδιότητες των ιοντικών ενώσεων και των δεσμών;
* Ιωνικές ενώσεις: Αυτές είναι ουσίες που σχηματίζονται από την ηλεκτροστατική έλξη μεταξύ θετικά φορτισμένων ιόντων (κατιόντων) και αρνητικά φορτισμένων ιόντων (Anions). Παραδείγματα περιλαμβάνουν το αλάτι επιτραπέζιου (NaCl) και το χλωριούχο ασβέστιο (CaCl₂).
* Ιονικά ομόλογα: Η δύναμη έλξης που συγκρατεί τα ιόντα μαζί σε μια ιοντική ένωση. Είναι μια ισχυρή ηλεκτροστατική αλληλεπίδραση.
Δείτε πώς σχετίζονται με την άποψη των ακινήτων:
1. Υψηλά σημεία τήξης και βρασμού:
* Ιωνικές ενώσεις: Έχουν υψηλά σημεία τήξης και βρασμού εξαιτίας των ισχυρών ηλεκτροστατικών δυνάμεων που συγκρατούν τα ιόντα μαζί στο κρυσταλλικό πλέγμα. Απαιτείται πολλή ενέργεια για να ξεπεραστούν αυτές οι δυνάμεις και να σπάσουν την ένωση.
* Ιονικά ομόλογα: Η ισχυρή φύση του ιοντικού δεσμού συμβάλλει άμεσα στα υψηλά σημεία τήξης και βρασμού.
2. Αγκυιεύσεις:
* Ιωνικές ενώσεις: Διεξάγουν ηλεκτρικό ρεύμα όταν είναι λιωμένο (υγρό) ή διαλύονται σε νερό (σχηματίζοντας ηλεκτρολύτη). Αυτό οφείλεται στο γεγονός ότι τα ιόντα είναι ελεύθερα να μετακινηθούν και να μεταφέρουν το ηλεκτρικό ρεύμα.
* Ιονικά ομόλογα: Η ικανότητα των ιόντων να μετακινούνται είναι άμεσο αποτέλεσμα του θραύσης του ιοντικού δεσμού σε αυτές τις καταστάσεις, επιτρέποντας τη ροή του φορτίου.
3. Διαλυτότητα:
* Ιωνικές ενώσεις: Γενικά, είναι διαλυτά σε πολικούς διαλύτες όπως το νερό. Τα πολικά μόρια του νερού μπορούν να περιβάλλουν και να αλληλεπιδρούν με τα φορτισμένα ιόντα, τραβώντας τα εκτός από το κρυσταλλικό πλέγμα.
* Ιονικά ομόλογα: Η αλληλεπίδραση μεταξύ των ιόντων και του πολικού διαλύτη (όπως το νερό) μπορεί να αποδυναμώσει τον ιοντικό δεσμό, οδηγώντας στην διάλυση της ένωσης.
Σημαντική σημείωση: Ενώ οι ιδιότητες των ιοντικών ενώσεων σχετίζονται άμεσα με τη δύναμη του ιοντικού δεσμού, δεν είναι το ίδιο πράγμα. Ο δεσμός είναι η δύναμη έλξης, ενώ η ένωση είναι η ουσία που σχηματίζεται λόγω αυτής της δύναμης.