Ιόντα θεατών σε υδατικό διάλυμα
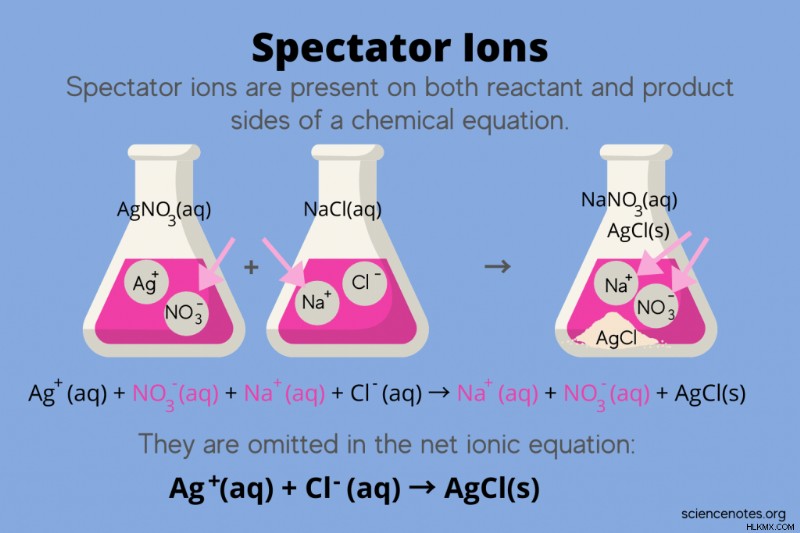
Στη χημεία, ιόντα θεατών είναι ιόντα που εμφανίζονται και ως αντιδρώντα και ως προϊόντα σε μια χημική εξίσωση, αλλά δεν επηρεάζουν την ισορροπία της αντίδρασης. Με άλλα λόγια, «βλέπουν» ή «παρακολουθούν» τα άλλα ιόντα να αντιδρούν σε ένα υδατικό διάλυμα (όταν ο διαλύτης είναι νερό). Επειδή τα ιόντα θεατών εμφανίζονται και στις δύο πλευρές του βέλους αντίδρασης, "ακυρώνονται" και δεν εμφανίζονται στην καθαρή ιοντική εξίσωση.
Ιόντα θεατών και η καθαρή ιοντική εξίσωση
Για παράδειγμα, η χημική εξίσωση για την αντίδραση μεταξύ του νιτρικού αργύρου (AgNO3 ) και το χλωριούχο νάτριο (NaCl) στο νερό εμφανίζει υδατικό νιτρικό νάτριο (NaNO3 ) και στερεό χλωριούχο άργυρο (AgCl) ως προϊόντα:
AgNO3 (aq) + NaCl(aq) → NaNO3 (aq) + AgCl(s)
Γράφοντας τη συνολική ιοντική εξίσωση αποκαλύπτονται τα ιόντα θεατή:
Ag(aq) + NO3 (aq) + Na(aq) + Cl(aq) → Na(aq) + NO3 (aq) + AgCl(s)
Το ιόν νατρίου (Na+) και το νιτρικό ιόν (NO3-) εμφανίζονται και στις δύο πλευρές της αντίδρασης, επομένως μπορείτε να τα ακυρώσετε ή να τα εξαλείψετε:
Ag(aq) + NO3 (aq) + Na(aq) + Cl(aq) → Na(aq) + ΟΧΙ3 (aq) + AgCl(s)
Αυτό αφήνει την καθαρή ιοντική εξίσωση :
Ag(aq) + Cl(aq) → AgCl(s)
Σημειώστε ότι η καθαρή ιοντική εξίσωση δείχνει μόνο τα χημικά είδη που συμμετέχουν άμεσα στην αντίδραση. Κατά σύμβαση, γράψτε πρώτα το κατιόν (σε αυτή την περίπτωση Ag) και μετά το ανιόν (σε αυτήν την περίπτωση, Cl). Η καθαρή ιοντική εξίσωση είναι μια ισορροπημένη χημική εξίσωση. Ο αριθμός και ο τύπος των ατόμων και στις δύο πλευρές του βέλους αντίδρασης είναι ο ίδιος. Το καθαρό φορτίο και στις δύο πλευρές του βέλους αντίδρασης είναι το ίδιο. Σε αυτήν την περίπτωση, το "+" και το "-" στην αριστερή πλευρά του βέλους εξουδετερώνουν το ένα το άλλο, επομένως το καθαρό φορτίο και στις δύο πλευρές του βέλους είναι 0.
Πώς να βρείτε ιόντα θεατών
Συνήθως, αναζητάτε μια αντίδραση διπλής αντικατάστασης (διπλής μετατόπισης) σε υδατικό διάλυμα όπου ένα από τα προϊόντα καθιζάνει ως στερεό. Αυτός ο τύπος αντίδρασης έχει την ακόλουθη γενική μορφή:
AB(aq) + CD(aq) → AD(aq) + CB(s) ή AB(aq) + CD(aq) → AD(s) + CB(aq)
Συχνά, αυτός ο τύπος αντίδρασης συμβαίνει μεταξύ δύο αλάτων ή μεταξύ οξέων και βάσεων ως αντίδραση εξουδετέρωσης. Εάν δεν γνωρίζετε εάν σχηματίζεται ίζημα, συμβουλευτείτε ένα διάγραμμα διαλυτότητας ή θυμηθείτε τους κανόνες διαλυτότητας.
Ορισμένα είδη εμφανίζονται συνήθως ως ιόντα θεατών:
| Κοινά κατιόντα θεατών | Κοινά ανιόντα θεατών |
|---|---|
| Li (ιόν λιθίου) | Cl (ιόν χλωρίου) |
| Na (ιόν νατρίου) | Br (ιόν βρωμιδίου) |
| Κ (ιόν καλίου) | I (ιόν ιωδιδίου) |
| Rb (ιόν ρουβιδίου) | ΟΧΙ3 (νιτρικό ιόν) |
| Sr (ιόν στροντίου) | ClO4 (υπερχλωρικό ιόν) |
| Ba (ιόν βαρίου) | SO4 (θειικό ιόν) |
Υπάρχουν εξαιρέσεις. Για παράδειγμα, θειικό ασβέστιο (CaSO4 ) είναι αδιάλυτο και σχηματίζει ίζημα.
Πρόβλημα παραδείγματος ιόντων θεατών
Για παράδειγμα, προσδιορίστε τα ιόντα θεατή και γράψτε την καθαρή ιοντική εξίσωση για την αντίδραση μεταξύ χλωριούχου νατρίου (NaCl) και θειικού χαλκού (CuSO4 ) στο νερό.
Το πρώτο βήμα είναι η πρόβλεψη των προϊόντων της αντίδρασης. Από τους κανόνες διαλυτότητας, γνωρίζετε ότι τόσο το χλωριούχο νάτριο όσο και ο θειικός χαλκός διασπώνται στα ιόντα τους στο νερό. Έτσι, υποθέτοντας ότι οι εταίροι ανταλλαγής ιόντων στην αντίδραση (αντίδραση διπλής αντικατάστασης), τα προϊόντα είναι θειικό νάτριο και χλωριούχος χαλκός. Εξισορροπώντας τα ιόντα για φορτίο, οι τύποι τους είναι Na2 SO4 και CuCl2 . Και πάλι από τους κανόνες διαλυτότητας, γνωρίζετε ότι το θειικό νάτριο είναι υδατικό, αλλά ο χλωριούχος χαλκός σχηματίζει ένα ίζημα.
NaCl(aq) + CuSO4 (aq) → Na2 SO4 (aq) + CuCl2 (s)
Η εξισορρόπηση της εξίσωσης απαιτεί την εισαγωγή συντελεστών:
2NaCl(a) + CuSO4 (aq) → Na2 SO4 (aq) + CuCl2 (aq)
Το επόμενο βήμα είναι η σύνταξη της ολικής ιοντικής εξίσωσης:
2Na(aq) + 2Cl(aq) + Cu(aq) + SO4 (aq) → 2Na(aq) + SO4 (aq) + CuCl2 (s)
Προσδιορίστε τα ιόντα θεατή αναζητώντας ιόντα που υπάρχουν και στις δύο πλευρές του βέλους αντίδρασης. Είναι Na και SO4 .
2Na(aq) + 2Cl(aq) + Cu(aq) + SO4 (aq) → 2Na(aq) + SO4 (aq) + CuCl2 (s)
Εξαλείψτε τα ιόντα θεατών:
2Na(aq) + 2Cl(aq) + Cu(aq) + SO4 (aq) → 2Na(aq) + SO4 (aq) + CuCl2 (s)
Αυτό αφήνει την καθαρή ιοντική εξίσωση:
2Cl(aq) + Cu(aq) → CuCl2 (s)
Αναδιάταξη της εξίσωσης έτσι ώστε το κατιόν να εμφανίζεται πριν από το ανιόν στα αντιδρώντα:
Cu(aq) + 2Cl(aq) → CuCl2 (s)
Σημασία των ιόντων θεατών
Αν και δεν συμμετέχουν στην καθαρή αντίδραση ή δεν επηρεάζουν την ισορροπία, τα ιόντα θεατών είναι σημαντικά. Η παρουσία τους επηρεάζει το μήκος Debye ή την ακτίνα Debye των φορέων φορτίου σε ένα διάλυμα. Αυτό σημαίνει ότι αυτά τα ιόντα λειτουργούν ως ηλεκτρική οθόνη, είτε προσελκύοντας αντίθετα φορτισμένα ιόντα είτε απωθώντας παρόμοια φορτισμένα ιόντα. Στα υγρά, το μήκος Debye επηρεάζει την αγωγιμότητα των ηλεκτρολυτών και των κολλοειδών.
Αναφορές
- Atkins P.; de Paula, J. (2006). Φυσική χημεία (8η έκδ.). W.H. Φρίμαν. ISBN 978-0-7167-8759-4.
- Laidler, K. J. (1978). Φυσική χημεία με βιολογικές εφαρμογές . Μπέντζαμιν/Κάμινγκς. ISBN 978-0-8053-5680-9.
- Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). Γενική Χημεία:Αρχές και Σύγχρονες Εφαρμογές (8η έκδ.). Upper Saddle River, N.J:Prentice Hall. ISBN 978-0-13-014329-7.
- Zumdahl, Steven S. (1997). Χημεία (4η έκδ.). Βοστώνη, MA:Houghton Mifflin Company. ISBN 9780669417944.




