Όσον αφορά τις διαμοριακές δυνάμεις γιατί το μεθανόλη αναμιγνύεται εύκολα με νερό, ενώ δεν είναι οκτάνιο;
μεθανόλη (CH3OH)
* δεσμός υδρογόνου: Η μεθανόλη έχει υδροξυλομάδα (-ΟΗ) που της επιτρέπει να σχηματίζει ισχυρούς δεσμούς υδρογόνου με μόρια νερού. Οι δεσμοί υδρογόνου είναι ο ισχυρότερος τύπος διαμοριακής δύναμης.
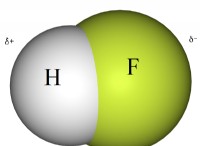
* αλληλεπιδράσεις διπόλης-διπόλης: Το μόριο μεθανόλης είναι πολικό λόγω της διαφοράς ηλεκτροαρνητικότητας μεταξύ οξυγόνου και υδρογόνου, με αποτέλεσμα τις αλληλεπιδράσεις διπολικής-διαδολίας. Το νερό είναι επίσης ένα πολικό μόριο, ενισχύοντας περαιτέρω την ανάμειξη.
Οκτάνιο (C8H18)
* Δυνάμεις διασποράς του Λονδίνου: Το οκτάνιο είναι ένα μη πολικό μόριο. Οι μόνες ενδομοριακές δυνάμεις που υπάρχουν είναι αδύναμες δυνάμεις διασποράς του Λονδίνου. Αυτές οι δυνάμεις προκύπτουν από προσωρινές, επαγόμενες διπόλες και είναι πολύ πιο αδύναμες από τη δέσμευση υδρογόνου.
* Έλλειψη δεσμών υδρογόνου: Το οκτάνιο στερείται της υδροξυλομάδας (-ΟΗ) που απαιτείται για τη σύνδεση υδρογόνου με νερό.
Η βασική διαφορά
Η σημαντική διαφορά έγκειται στην ικανότητα σχηματισμού δεσμών υδρογόνου. Τα μόρια του νερού προσελκύονται έντονα από την υδροξυλική ομάδα μεθανόλης μέσω της σύνδεσης υδρογόνου, οδηγώντας σε ευνοϊκές αλληλεπιδράσεις που τους επιτρέπουν να αναμειγνύονται εύκολα. Οκτάνιο, που στερείται αυτής της ικανότητας, βιώνει μόνο αδύναμες δυνάμεις διασποράς του Λονδίνου με νερό, καθιστώντας την ανάμειξη δυσμενείς.
Συνοπτικά:
* μεθανόλη: Ισχυρή δέσμευση υδρογόνου με νερό.
* Οκτάνιο: Αδύναμες δυνάμεις διασποράς του Λονδίνου με νερό.
Αυτή η διαφορά στις διαμοριακές δυνάμεις εξηγεί τις πολύ διαφορετικές ιδιότητες διαλυτότητας της μεθανόλης και του οκτανίου στο νερό.