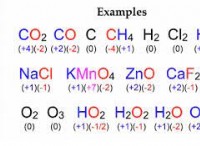
Τι είναι τα ισότοπα ενός στοιχείου;
Εδώ είναι μια κατανομή:
* πρωτόνια: Καθορίστε το στοιχείο. Για παράδειγμα, όλα τα άτομα άνθρακα έχουν 6 πρωτόνια.
* νετρόνια: Μπορεί να ποικίλει μέσα σε ένα στοιχείο. Για παράδειγμα, ο άνθρακας-12 έχει 6 νετρόνια, ενώ ο άνθρακας-14 έχει 8 νετρόνια.
* Ατομική μάζα: Το άθροισμα των πρωτονίων και των νετρονίων. Ο άνθρακας-12 έχει ατομική μάζα 12, ενώ ο άνθρακας-14 έχει ατομική μάζα 14.
Βασικά σημεία για τα ισότοπα:
* Χημική συμπεριφορά: Τα ισότοπα του ίδιου στοιχείου έχουν πολύ παρόμοιες χημικές ιδιότητες επειδή έχουν τον ίδιο αριθμό ηλεκτρονίων και επομένως την ίδια διαμόρφωση ηλεκτρονίων.
* Φυσικές ιδιότητες: Τα ισότοπα μπορούν να έχουν ελαφρώς διαφορετικές φυσικές ιδιότητες, όπως πυκνότητα ή σημείο τήξης, λόγω της διαφοράς στη μάζα.
* ραδιενέργεια: Ορισμένα ισότοπα είναι ραδιενεργά, δηλαδή οι πυρήνες τους είναι ασταθής και αποσυντίθεται με την πάροδο του χρόνου, εκπέμποντας σωματίδια και ενέργεια.
* χρησιμοποιεί: Τα ισότοπα έχουν διάφορες εφαρμογές, όπως:
* Ιατρική απεικόνιση: Τα ραδιενεργά ισότοπα χρησιμοποιούνται σε τεχνικές ιατρικής απεικόνισης όπως σαρώσεις κατοικίδιων ζώων.
* Ακτινοθεραπεία: Τα ραδιενεργά ισότοπα χρησιμοποιούνται για τη θεραπεία του καρκίνου.
* χρονολόγηση: Τα ραδιενεργά ισότοπα όπως το Carbon-14 χρησιμοποιούνται για τον προσδιορισμό της ηλικίας των απολιθωμάτων και των αντικειμένων.
Παραδείγματα:
* Carbon-12 και Carbon-14: Και τα δύο είναι ισότοπα άνθρακα. Το Carbon-14 είναι ραδιενεργό και χρησιμοποιείται σε χρονολόγηση ραδιοανθράκων.
* υδρογόνο-1 (πρωτόνιο), υδρογόνο-2 (δευτέριο) και υδρογόνο-3 (τρίτιο): Αυτά είναι όλα τα ισότοπα υδρογόνου, με διαφορετικούς αριθμούς νετρονίων.
Η κατανόηση των ισότοπων είναι ζωτικής σημασίας σε διάφορους επιστημονικούς τομείς, συμπεριλαμβανομένης της χημείας, της φυσικής, της βιολογίας και της γεωλογίας.