Τι είναι ένα μόριο ή ένα ιόν με γραμμικό σχήμα;
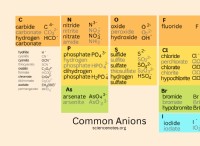
Μόρια:
* διοξείδιο του άνθρακα (CO₂): Το άτομο άνθρακα είναι διπλό συνδεδεμένο σε κάθε άτομο οξυγόνου. Οι δύο διπλοί δεσμοί απέχουν 180 μοίρες, δημιουργώντας ένα γραμμικό σχήμα.
* Κυανίδιο υδρογόνου (HCN): Το άτομο άνθρακα είναι τριπλό συνδεδεμένο με το άτομο αζώτου και συνδέεται μεμονωμένα με το άτομο υδρογόνου. Οι δύο δεσμοί απέχουν επίσης 180 μοίρες, οδηγώντας σε γραμμική δομή.
* ακετυλενίου (C₂H₂): Αυτό το μόριο έχει δύο άτομα άνθρακα που συνδέονται με τριπλό δεσμό και κάθε άτομο άνθρακα συνδέεται μεμονωμένα με ένα άτομο υδρογόνου. Αυτό δημιουργεί και πάλι μια γραμμική δομή.
ιόντα:
* ιόν ανθρακικού άλατος (co₃²⁻): Αυτό το ιόν έχει δομή συντονισμού με δύο διπλούς δεσμούς και έναν μόνο δεσμό. Το άτομο άνθρακα είναι υβριδοποιημένο και τα τρία άτομα είναι διατεταγμένα σε τριγωνική επίπεδη γεωμετρία. Ωστόσο, τα μοναδικά ζεύγη στα άτομα οξυγόνου αλληλεπιδρούν, με αποτέλεσμα ένα γραμμικό σχήμα για ολόκληρο το μόριο.
* ιόν κυανιούχου (CN⁻): Το άτομο άνθρακα είναι τριπλό συνδεδεμένο με το άτομο αζώτου. Αυτός ο τριπλός δεσμός αναγκάζει το μόριο να υιοθετήσει μια γραμμική γεωμετρία.
Γενικός κανόνας:
Ένα μόριο ή ένα ιόν θα είναι γραμμικό εάν έχει δύο τομείς ηλεκτρονίων γύρω από το κεντρικό άτομο. Αυτοί οι τομείς ηλεκτρονίων μπορούν να είναι μεμονωμένοι δεσμοί, διπλοί δεσμοί, τριπλοί δεσμοί ή ζεύγη μοναχικών.
Σημαντική σημείωση:
Το γραμμικό σχήμα ενός μορίου ή ιόντων προσδιορίζεται από τη διάταξη των ζευγών ατόμων και ηλεκτρονίων γύρω από το κεντρικό άτομο. Αυτή η ρύθμιση υπαγορεύεται από τις αρχές της θεωρίας VSEPR (Απομάκρυνση ζεύγους ηλεκτρονίων σθένους).