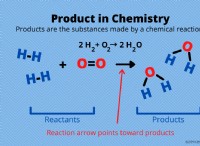
Πώς αντιδρούν το μαγνήσιο και το σίδηρο με οξυγόνο;
μαγνήσιο (mg)
* αντίδραση: Το μαγνήσιο αντιδρά έντονα με οξυγόνο, παράγοντας ένα φωτεινό λευκό φως και θερμότητα. Αυτό είναι ένα κλασικό παράδειγμα μιας αντίδρασης καύσης.
* Εξίσωση: 2 mg (s) + o₂ (g) → 2 mgo (s)
* Προϊόν: Το οξείδιο του μαγνησίου (MGO) σχηματίζεται, μια λευκή σκόνη.
IRON (FE)
* αντίδραση: Ο σίδηρος αντιδρά πιο αργά με οξυγόνο, ειδικά σε θερμοκρασία δωματίου. Η αντίδραση επιταχύνεται από την παρουσία υγρασίας και αλατιού.
* Εξίσωση: 4 Fe (s) + 3 o₂ (g) → 2 fe₂o₃ (s)
* Προϊόν: Το οξείδιο του σιδήρου (Fe₂o₃), κοινώς γνωστό ως σκουριά, σχηματίζεται ως κοκκινωπό-καφέ επικάλυψη στην επιφάνεια του σιδήρου.
Βασικές διαφορές:
* ταχύτητα: Το μαγνήσιο αντιδρά πολύ πιο γρήγορα από το σίδερο.
* εμφάνιση: Η αντίδραση του μαγνησίου παράγει ένα φωτεινό λευκό φως, ενώ η σκουριά σίδηρος είναι μια σταδιακή διαδικασία.
* Προϊόντα: Το οξείδιο του μαγνησίου είναι μια σταθερή ένωση, ενώ το οξείδιο του σιδήρου (σκουριά) μπορεί να συνεχίσει να αντιδρά και να εξαπλώνεται.
Παράγοντες που επηρεάζουν την αντιδραστικότητα:
* Θερμοκρασία: Οι υψηλότερες θερμοκρασίες αυξάνουν τον ρυθμό αντίδρασης και για τα δύο μέταλλα.
* επιφάνεια: Μια μεγαλύτερη επιφάνεια του μετάλλου που εκτίθεται σε οξυγόνο θα αυξήσει τον ρυθμό αντίδρασης.
* Παρουσία νερού: Το νερό επιταχύνει τη σκουριά του σιδήρου, ενεργώντας ως καταλύτης.
Πρακτικές εφαρμογές:
* μαγνήσιο: Χρησιμοποιείται σε φωτοβολίδες και πυροτεχνήματα λόγω του φωτεινού φωτός του.
* Σίδερο: Η σκουριά είναι ένα πρόβλημα σε πολλές βιομηχανίες, αλλά το οξείδιο του σιδήρου χρησιμοποιείται επίσης ως χρωστική ουσία σε χρώματα και ως συστατικό στις ροές συγκόλλησης.