Διαφορά μεταξύ μοριακής μάζας και μοριακού βάρους
Κύρια διαφορά – Μοριακή μάζα έναντι μοριακού βάρους
Τα μόρια είναι ουσίες που σχηματίζονται λόγω συνδυασμών ίδιων ή διαφορετικών ατόμων σε διαφορετικές αναλογίες. Αυτά τα μόρια μπορούν να συνδεθούν μεταξύ τους για να σχηματίσουν ενώσεις. Σχεδόν όλες οι χημικές αντιδράσεις εμπλέκονται και οι αλλαγές συμβαίνουν σε μόρια ή ενώσεις. Ως εκ τούτου, είναι πολύ σημαντικό να κατανοήσουμε τις χημικές και φυσικές ιδιότητες των μορίων προκειμένου να διεξάγουμε χημικές αντιδράσεις και να προβλέψουμε τα τελικά προϊόντα. Η μοριακή μάζα και το μοριακό βάρος είναι δύο τέτοιες φυσικές ιδιότητες των ουσιών. Η κύρια διαφορά μεταξύ της μοριακής μάζας και του μοριακού βάρους είναι ότι η μοριακή μάζα δίνει τη μάζα ενός mol μιας συγκεκριμένης ουσίας ενώ μοριακό βάρος είναι η μάζα ενός μορίου μιας συγκεκριμένης ουσίας.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η μοριακή μάζα
– Ορισμός, Τύπος, Μονάδες, Υπολογισμός
2. Τι είναι το μοριακό βάρος
– Ορισμός, Τύπος, Μονάδες, Υπολογισμός
3. Ποια είναι η διαφορά μεταξύ Μοριακής Μάζας και Μοριακού Βάρους
– Σύγκριση βασικών διαφορών
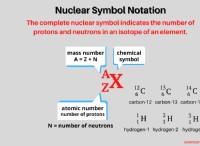
Βασικοί όροι:Άτομα, Άνθρακα, Ισότοπο, Μοριακή μάζα, Μοριακή μάζα, Μοριακό Βάρος

Τι είναι η Μοριακή Μάζα
Η μοριακή μάζα είναι η μάζα ενός mol μιας συγκεκριμένης ουσίας. Είναι μια φυσική ιδιότητα των ουσιών. Η μοριακή μάζα προκύπτει διαιρώντας τη μάζα μιας συγκεκριμένης ουσίας με την ποσότητα της. 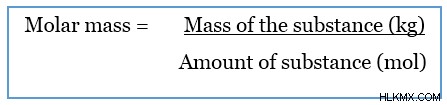
Η μονάδα SI για τη μοριακή μάζα είναι kgmolor kg/mol. Γενικά όμως δίνεται στη μονάδα gmol ή g/mol.
Η μοριακή μάζα ενός στοιχείου είναι η ατομική μάζα αυτού του στοιχείου. Επομένως, η μοριακή μάζα μιας ουσίας μπορεί να υπολογιστεί προσθέτοντας τις ατομικές μάζες κάθε στοιχείου που υπάρχει σε αυτό το μόριο.
Υπολογισμός Μοριακής Μάζας
Ας υπολογίσουμε τη μοριακή μάζα του H2 O σύνθετο.
H2 Ο:
- Αριθμός ατόμων υδρογόνου που υπάρχουν =2
- Ατομική μάζα υδρογόνου =1,00794 g/mol
- Αριθμός υπαρχόντων ατόμων οξυγόνου =1
- Ατομική μάζα οξυγόνου =15,999 g/mol
- Ως εκ τούτου, η μοριακή μάζα του H2 O =(2 x 1,00794 g/mol) + (1 x 15,999 g/mol)
=18,01488 g/mol
Αυτός ο απλός υπολογισμός δείχνει ότι η μάζα ενός mole H2 Η ένωση O είναι 18 g.
Τι είναι το μοριακό βάρος
Ο όρος μοριακό βάρος μπορεί να οριστεί ως η μάζα ενός μορίου. Ονομάζεται επίσης σχετική μοριακή μάζα . Αυτό συμβαίνει επειδή το μοριακό βάρος υπολογίζεται ως η μάζα, σε σχέση με το ισότοπο άνθρακα-12.
Λαμβάνοντας υπόψη ένα υποθετικό μόριο που ονομάζεται Α, 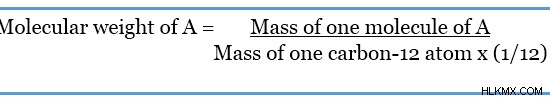
Η παραπάνω εξίσωση δείχνει ότι το μοριακό βάρος δεν έχει μονάδες. Αυτό συμβαίνει γιατί η διαίρεση γίνεται μεταξύ δύο μαζών που έχουν τις ίδιες μονάδες. Επομένως, το μοριακό βάρος δίνεται ως μονάδες ατομικής μάζας ή amu. Χρησιμοποιώντας την παραπάνω εξίσωση, μπορούμε να βρούμε το μοριακό βάρος ενός στοιχείου ή μιας ένωσης. Επομένως, όπως και στη μοριακή μάζα, το μοριακό βάρος ενός συγκεκριμένου μορίου είναι ίσο με το άθροισμα των ατομικών μαζών κάθε στοιχείου.
Υπολογισμός του μοριακού βάρους
Αν εξετάσουμε το ίδιο παράδειγμα H2 O,
- Ο αριθμός των ατόμων υδρογόνου που υπάρχουν =2
- Ο αριθμός των ατόμων οξυγόνου που υπάρχουν =1
- Μάζα ατόμου υδρογόνου =1,00794 amu
- Μάζα ατόμου οξυγόνου =15,999 amu
- Επομένως το μοριακό βάρος του H2 O =(2 x 1,00794 amu) + (1 x 15,999 amu)
=18,01488 amu
Αυτό δείχνει ότι τόσο η μοριακή μάζα όσο και η μοριακή μάζα είναι ίδιες στις τιμές τους αλλά διαφέρουν στις μονάδες τους.
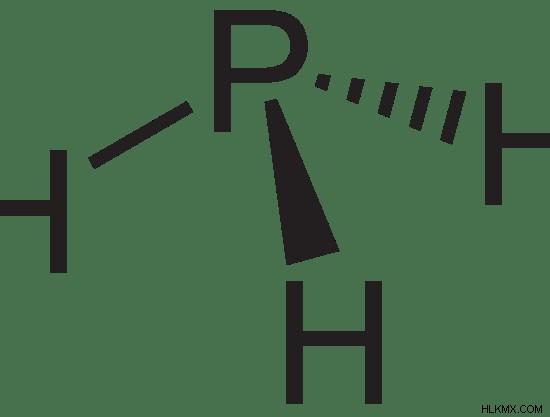
Εικόνα 1:Φωσφίνη. Η μοριακή μάζα της φωσφίνης είναι 33,99758 g/mol. Το μοριακό βάρος είναι 33,99758 amu.
Διαφορά μεταξύ Μοριακής Μάζας και Μοριακού Βάρους
Ορισμός
Μοριακή μάζα: Μοριακή μάζα είναι η μάζα ενός mol μιας συγκεκριμένης ουσίας.
Μοριακό βάρος: Ο όρος μοριακό βάρος μπορεί να οριστεί ως η μάζα ενός μορίου.
Μονάδες
Μοριακή μάζα: Η μονάδα μοριακής μάζας είναι kgmol-1 (ή kg/mol).
Μοριακό βάρος: Το μοριακό βάρος είναι χωρίς μονάδα, αλλά δίνεται ως amu (ή μονάδες ατομικής μάζας).
Υπολογισμός
Μοριακή μάζα: Η μοριακή μάζα υπολογίζεται διαιρώντας τη μάζα μιας ουσίας με την ποσότητα της ουσίας.
Μοριακό βάρος: Το μοριακό βάρος υπολογίζεται ως η μάζα της ουσίας σε σχέση με το 1/12 της μάζας του ατόμου άνθρακα-12.
Συμπέρασμα
Η κύρια διαφορά μεταξύ της μοριακής μάζας και του μοριακού βάρους είναι ότι η μοριακή μάζα δίνει τη μάζα ενός μορίου μιας συγκεκριμένης ουσίας, ενώ το μοριακό βάρος είναι η μάζα ενός μορίου μιας συγκεκριμένης ουσίας. Αν και ο ορισμός και οι μονάδες είναι διαφορετικοί για τη μοριακή μάζα και το μοριακό βάρος, η τιμή είναι η ίδια. Είναι φυσικές ιδιότητες ουσιών και είναι πολύ χρήσιμες σε τεχνικές χημικής ανάλυσης.