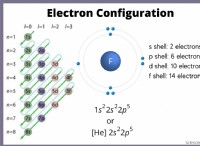
Τι είδους δεσμοί είναι δυνατοί μεταξύ του άνθρακα και του οξυγόνου;
1. Ομοιοπολικοί δεσμοί:
* Ενιαίος δεσμός (C-O): Αυτός είναι ο πιο συνηθισμένος τύπος δεσμού μεταξύ άνθρακα και οξυγόνου. Περιλαμβάνει την ανταλλαγή ενός ζεύγους ηλεκτρονίων. Παραδείγματα περιλαμβάνουν αλκοόλες, αιθέρες και αλδεΰδες.
* διπλός δεσμός (c =o): Αυτό περιλαμβάνει την ανταλλαγή δύο ζευγαριών ηλεκτρονίων. Αυτός είναι ένας ισχυρός δεσμός και υπάρχει σε κετόνες, αλδεΰδες και καρβοξυλικά οξέα.
2. Συντονισμός ομοιοπολικού δεσμού (Dative ομοιοπολικός δεσμός):
* Αυτός ο τύπος δεσμού εμφανίζεται σε μονοξείδιο του άνθρακα (CO). Εδώ, το οξυγόνο δωρίζει και τα δύο ηλεκτρόνια στο κοινό ζευγάρι.
Είναι σημαντικό να σημειωθεί ότι η πολικότητα Bond Μεταξύ του άνθρακα και του οξυγόνου είναι σημαντική. Το οξυγόνο είναι πιο ηλεκτροαρνητικό από τον άνθρακα, που σημαίνει ότι προσελκύει τα κοινόχρηστα ηλεκτρόνια πιο έντονα. Αυτό οδηγεί σε ένα μερικό αρνητικό φορτίο στο άτομο οξυγόνου και ένα μερικό θετικό φορτίο στο άτομο άνθρακα. Αυτή η πολικότητα συμβάλλει στην αντιδραστικότητα και τις ιδιότητες των μορίων που περιέχουν δεσμούς άνθρακα-οξυγόνου.