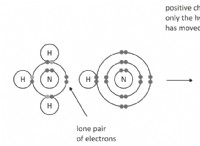
Γιατί οι ιοντικές ενώσεις συνήθως έχουν υψηλό σημείο τήξης ενώ το πιο απλό ομοιοπολικό χαμηλό σημείο;
Ιωνικές ενώσεις
* Ισχυρά ηλεκτροστατικά αξιοθέατα: Οι ιοντικές ενώσεις σχηματίζονται από την ηλεκτροστατική έλξη μεταξύ των αντίθετα φορτισμένων ιόντων (κατιόντα και ανιόντες). Αυτά τα αξιοθέατα είναι πολύ ισχυρά και απαιτούν σημαντική ποσότητα ενέργειας για να ξεπεραστεί.
* Δομή πλέγματος: Οι ιοντικές ενώσεις σχηματίζουν μια άκαμπτη, τρισδιάστατη δομή πλέγματος όπου τα ιόντα είναι σφιχτά συσκευασμένα μαζί. Αυτή η δομή ενισχύει περαιτέρω τη δύναμη των ηλεκτροστατικών δυνάμεων.
* υψηλά σημεία τήξης: Για να λιώσει μια ιοντική ένωση, πρέπει να παρέχετε αρκετή ενέργεια για να σπάσετε τους ισχυρούς ηλεκτροστατικούς δεσμούς που κρατούν τα ιόντα μαζί στο πλέγμα. Αυτό απαιτεί πολλή θερμότητα, με αποτέλεσμα τα υψηλά σημεία τήξης.
απλές ομοιοπολικές ενώσεις
* αδύναμες διαμοριακές δυνάμεις: Οι απλές ομοιοπολικές ενώσεις σχηματίζονται με την κοινή χρήση ηλεκτρονίων μεταξύ των ατόμων, δημιουργώντας ομοιοπολικούς δεσμούς. Οι δεσμοί εντός των μορίων είναι ισχυροί, αλλά οι δυνάμεις που συγκρατούν τα μόρια μαζί (ενδομοριακές δυνάμεις) είναι σχετικά αδύναμες. Αυτές οι δυνάμεις μπορούν να είναι οι δυνάμεις van der Waals, οι αλληλεπιδράσεις διπολικής-διπόλης ή οι δεσμοί υδρογόνου.
* χαμηλά σημεία τήξης: Απαιτείται μόνο μια μικρή ποσότητα ενέργειας για να ξεπεραστούν οι αδύναμες διαμοριακές δυνάμεις και να σπάσουν τα μόρια, οδηγώντας σε χαμηλά σημεία τήξης.
Παραδείγματα
* Ιονική: Το χλωριούχο νάτριο (NaCl) λιώνει στους 801 ° C.
* ομοιοπολικό: Το νερό (H₂O) λιώνει στους 0 ° C.
Συνοπτικά
Η διαφορά στα σημεία τήξης προκύπτει από τη φύση της σύνδεσης και τη δύναμη των δυνάμεων που συγκρατούν τα σωματίδια μαζί. Οι ιοντικές ενώσεις έχουν ισχυρές ηλεκτροστατικές δυνάμεις εντός της δομής πλέγματος τους, απαιτώντας υψηλή ενέργεια για να ξεπεραστεί. Οι ομοιοπολικές ενώσεις έχουν ασθενέστερες διαμοριακές δυνάμεις, καθιστώντας τους ευκολότερους να λιώσουν.