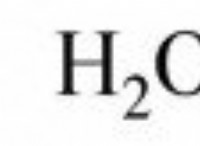Για την ακόλουθη εξίσωση SNO2 PLUS 2H2 ισούται με SN 2H20 Πόσα γραμμάρια σχηματίζονται αν χρησιμοποιηθεί 12,5 πρώτα αντιδραστήρια;
1. Ισορροπημένη χημική εξίσωση
Η ισορροπημένη χημική εξίσωση είναι:
Sno₂ + 2h₂ → sn + 2h₂o
Αυτό μας λέει ότι η στοιχειομετρική αναλογία:1 mole του sno₂ αντιδρά με 2 moles του H₂ για να παράγει 1 mole sn και 2 moles του H₂O.
2. Μοριακές μάζες
* Sno₂ (οξείδιο του κασσίτερου (iv)):118,71 g/mol (SN) + 2 * 16,00 g/mol (O) =150,71 g/mol
* SN (TIN):118,71 g/mol
3. Υπολογίστε τα moles του sno₂
* Moles του sno₂ =(μάζα του sno₂) / (μοριακή μάζα του sno₂)
* Moles του Sno₂ =12,5 g / 150,71 g / mol =0,083 moles
4. Υπολογίστε τα moles του Sn
* Από την ισορροπημένη εξίσωση, 1 mole του sno₂ παράγει 1 mole του Sn.
* Επομένως, 0,083 moles του Sno₂ θα παράγουν 0,083 moles του Sn.
5. Υπολογίστε τη μάζα SN
* Μάζα Sn =(Moles του Sn) * (μοριακή μάζα SN)
* Μάζα Sn =0,083 moles * 118,71 g/mol =9,86 g
απάντηση: Περίπου 9.86 γραμμάρια του SN θα σχηματιστεί.