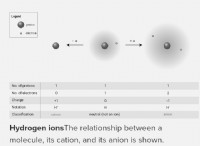
Όταν το χλώριο κερδίζει ένα ηλεκτρόνιο για να γίνει ένα χλωριούχο ιόν με -1 φορτίο καταλήγει στην ίδια διάταξη με το αργόν. Γιατί το Atom Atom;
Κατανόηση της διαμόρφωσης ηλεκτρονίων
* Κεφάλαια ηλεκτρονίων: Τα άτομα έχουν ηλεκτρόνια διατεταγμένα σε επίπεδα ενέργειας που ονομάζονται κελύφη. Κάθε κέλυφος μπορεί να κρατήσει έναν συγκεκριμένο αριθμό ηλεκτρονίων.
* ηλεκτρόνια σθένους: Τα ηλεκτρόνια στο εξωτερικό κέλυφος ονομάζονται ηλεκτρόνια σθένους και εμπλέκονται στη χημική σύνδεση.
* σταθερότητα: Τα άτομα προσπαθούν να επιτύχουν μια σταθερή διαμόρφωση, συνήθως με ένα πλήρες εξωτερικό κέλυφος ηλεκτρονίων.
χλώριο (CL) και αργόν (AR)
* χλώριο: Το χλώριο έχει 17 ηλεκτρόνια. Η διαμόρφωσή του ηλεκτρονίων είναι 2, 8, 7. Αυτό σημαίνει ότι έχει 7 ηλεκτρόνια σθένους στο εξωτερικό κέλυφος του.
* αργόν: Το Argon έχει 18 ηλεκτρόνια. Η διαμόρφωση ηλεκτρονίων είναι 2, 8, 8. Έχει ένα πλήρες εξωτερικό κέλυφος 8 ηλεκτρονίων, καθιστώντας το πολύ σταθερό.
Η αντίδραση
Όταν το χλώριο κερδίζει ένα ηλεκτρόνιο, γίνεται ένα ιόν χλωριούχου (CL⁻).
* Χλωρίνη κερδίζοντας ένα ηλεκτρόνιο: Cl + e⁻ → cl⁻
* Διαμόρφωση ηλεκτρονίων του χλωριούχου ιόντος: Το προστιθέμενο ηλεκτρόνιο γεμίζει το εξώτατο κέλυφος, δίνοντάς του την ίδια διαμόρφωση με το Argon (2, 8, 8).
Γιατί Argon;
* σταθερότητα: Το Argon είναι ένα ευγενές αέριο, που σημαίνει ότι έχει ένα πλήρες εξωτερικό κέλυφος ηλεκτρονίων. Αυτό το καθιστά εξαιρετικά σταθερό και μη αντιδραστικό.
* Κανόνας οκτάδων: Το ιόν χλωριούχου (CL⁻) έχει τώρα 8 ηλεκτρόνια στο εξώτατο κέλυφος του, ικανοποιώντας τον κανόνα οκτάδων, ο οποίος δηλώνει ότι τα άτομα τείνουν να κερδίζουν, να χάνουν ή να μοιράζονται ηλεκτρόνια για να επιτύχουν 8 ηλεκτρόνια στο εξώτατο κέλυφος τους.
Συνοπτικά
Με την απόκτηση ενός ηλεκτρονίου, το χλώριο επιτυγχάνει την ίδια σταθερή διαμόρφωση ηλεκτρονίων με το Argon, το οποίο είναι ένα πολύ σταθερό ευγενές αέριο. Αυτός είναι ο λόγος για τον οποίο το χλώριο, όταν κερδίζει ένα ηλεκτρόνιο, γίνεται πιο σταθερό και σχηματίζει ένα ιόν χλωριούχου.