Διαφορά μεταξύ ιοντικών και ομοιοπολικών ενώσεων
Κύρια διαφορά – Ιονικές έναντι ομοιοπολικών ενώσεων
Σχεδόν όλες οι ενώσεις στη Χημεία μπορούν να κατηγοριοποιηθούν ευρέως σε Ιονικές και Ομοιοπολικές Ενώσεις. Διαφέρουν μεταξύ τους λόγω του τύπου δεσμού μεταξύ των ατόμων που συμμετέχουν στη δημιουργία ενός μορίου/ένωσης. Όπως υποδηλώνουν τα ονόματά τους,οι ιοντικές ενώσεις αποτελούνται από ιοντικούς δεσμούς και οι ομοιοπολικές ενώσεις από ομοιοπολικούς δεσμούς. Οι ιονικοί δεσμοί συμβαίνουν μεταξύ δύο ειδών που έλκονται ηλεκτροστατικά το ένα προς το άλλο, ενώ τα ομοιοπολικά άτομα συνδέονται ομοιοπολικά μέσω της κοινής χρήσης ηλεκτρονίων μεταξύ των εξωτερικών φλοιών τους . Αυτή είναι η κύρια διαφορά μεταξύ ιοντικών και ομοιοπολικών ενώσεων. Γενικά, τα μεταλλικά στοιχεία τείνουν να σχηματίζουν ιοντικές ενώσεις και τα μη μεταλλικά στοιχεία καταλήγουν σε ομοιοπολικούς δεσμούς.
Τι είναι οι ιοντικές ενώσεις
Όπως αναφέρθηκε παραπάνω, οι ιοντικές ενώσεις είναι αποτέλεσμα ηλεκτροστατικών δυνάμεων μεταξύ των ατόμων που έλκονται το ένα προς το άλλο λόγω της κατοχής αντίθετων ηλεκτρικών φορτίων. Κάθε στοιχείο προσπαθεί να επιτύχει μια σταθερή ηλεκτρονική διαμόρφωση στο εξωτερικό κέλυφος (ηλεκτρονική διαμόρφωση των ευγενών αερίων). Η ηλεκτρονική διαμόρφωση ευγενούς αερίου αποτρέπει τα άτομα από περαιτέρω αντιδράσεις καθώς είναι ήδη σταθερά. Ως εκ τούτου, στοιχεία στη φύση που δεν είναι ηλεκτρονικά σταθερά, τείνουν να δίνουν τυχόν επιπλέον ηλεκτρόνια ή να δέχονται τον αριθμό ηλεκτρονίων που λείπει για να επιτευχθεί η πλησιέστερη διαμόρφωση ευγενούς αερίου. Τα ιόντα σχηματίζονται από αυτή την αρχή. Τα άτομα που τείνουν να δίνουν τα επιπλέον ηλεκτρόνια τους για να επιτύχουν σταθερή ηλεκτρονική διαμόρφωση καταλήγουν να είναι θετικά φορτισμένα (λόγω της απώλειας αρνητικά φορτισμένων ηλεκτρονίων) και αυτά ονομάζονται «κατιόντα .» Ομοίως, όταν τα άτομα δέχονται ηλεκτρόνια για να ολοκληρώσουν την τελική διαμόρφωση του φλοιού, φορτίζονται αρνητικά (λόγω της αύξησης των αρνητικά φορτισμένων ηλεκτρονίων) και αυτά ονομάζονται «ανιόντα .» Επομένως, εξ ορισμού, σχηματίζονται ιονικοί δεσμοί μεταξύ ανιόντων και κατιόντων .
Γενικά, τα άτομα που σχηματίζουν ιοντικές ενώσεις περιβάλλονται από τα αντίθετα φορτισμένα άτομα. Επομένως, ομαδοποιούνται σε συστάδες που ονομάζονται «κρύσταλλοι», αντί να σχηματίζουν μεμονωμένες μοριακές οντότητες. Ως εκ τούτου, οι ιοντικές ενώσεις τείνουν να είναι στερεής φύσης και συνήθως έχουν πολύ υψηλά σημεία τήξης καθώς οι ιοντικοί δεσμοί είναι αρκετά ισχυροί. στην πραγματικότητα είναι ο ισχυρότερος τύπος χημικού δεσμού που υπάρχει. Σε υγρή μορφή, γίνονται εξαιρετικά αγώγιμα υλικά καθώς τα ιόντα ταξιδεύουν ελεύθερα. Τα ιόντα μπορεί να είναι ατομικής ή μοριακής φύσης. δηλαδή CO3 είναι ένα μοριακό ανιόν. Στην περίπτωση που το Η (Υδρογόνο) είναι το κατιόν, η ένωση ονομάζεται οξύ και όταν το ανιόν είναι ΟΗ ονομάζεται βάση. Λίγα παραδείγματα ιοντικών ενώσεων είναι τα NaCl, MgCl2, και τα λοιπά. 
Τι είναι οι ομοιοπολικές ενώσεις
Πρόκειται για ενώσεις που σχηματίζονται από ομοιοπολικά συνδεδεμένα άτομα. Οι ομοιοπολικοί δεσμοί είναι πολύ πιο αδύναμοι από τους ιοντικούς δεσμούς και, ως εκ τούτου, οι περισσότερες από τις ομοιοπολικές ενώσεις υπάρχουν στην αέρια φάση. Όπως αναφέρθηκε παραπάνω, τα άτομα πρέπει να σχηματίσουν ενώσεις προκειμένου να επιτύχουν μια σταθερή ηλεκτρονική διαμόρφωση. Και ο τρίτος τρόπος απόκτησης αυτού (εκτός από την παροχή και την αποδοχή ηλεκτρονίων όπως αναφέρεται στην περίπτωση των ιοντικών δεσμών) είναι μέσω της κοινής χρήσης ηλεκτρονίων.
Σε αυτή τη μέθοδο, και τα δύο άτομα που συμμετέχουν στο σχηματισμό της ένωσης μοιράζονται τον απαιτούμενο αριθμό ηλεκτρονίων (συνήθως με ένα άτομο δότη και ένα άτομο δέκτη που αναζητούν την ίδια ποσότητα ηλεκτρονίων) σε κοινό επικαλυπτόμενο τροχιακό χώρο. Είναι σημαντικό τα άτομα να έρχονται σε στενή γειτνίαση μεταξύ τους για την τροχιακή επικάλυψη πριν πραγματοποιηθεί η κοινή χρήση ηλεκτρονίων. Επομένως, σε αυτή την περίπτωση, κανένα άτομο δεν θα είναι ηλεκτρικά φορτισμένο αλλά θα παραμείνει ουδέτερο. Η επικάλυψη μπορεί να γίνει με γραμμικό τρόπο ή με παράλληλο τρόπο. Όταν είναι κατευθυνόμενος και γραμμικός, ο τύπος του δεσμού ονομάζεται «σ δεσμός» και στην άλλη περίπτωση είναι «δεσμός π». Επιπλέον, αυτή η κοινή χρήση ηλεκτρονίων μπορεί να λάβει χώρα μεταξύ παρόμοιου τύπου ατόμων καθώς και διαφορετικών τύπων ατόμων. Όταν τα εμπλεκόμενα άτομα είναι παρόμοια, η ένωση που προκύπτει ονομάζεται «διατομικό μόριο». H2 O, CO2, κ.λπ. είναι μερικά κοινά παραδείγματα. 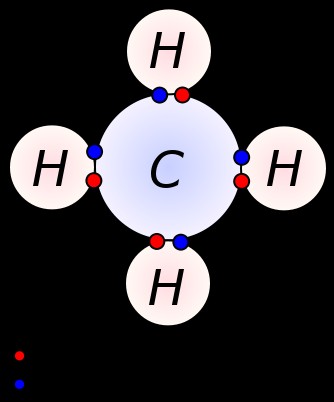
Διαφορά μεταξύ ιοντικών ενώσεων και ομοιοπολικών ενώσεων
Ορισμός
Ιωνικό Οι ενώσεις αποτελούνται από ιοντικούς δεσμούς όπου τα άτομα έλκονται ηλεκτροστατικά το ένα προς το άλλο.
Ομοιοπολικό Οι ενώσεις αποτελούνται από ομοιοπολικούς δεσμούς όπου τα ηλεκτρόνια μοιράζονται μεταξύ των ατόμων που συμμετέχουν στο σχηματισμό.
Είδη που εμπλέκονται
Ιωνικό Οι ενώσεις εμφανίζονται μέσω της αλληλεπίδρασης μεταξύ κατιόντων και ανιόντων.
Ομοιοπολικό Οι ενώσεις εμφανίζονται μέσω της αλληλεπίδρασης ουδέτερων ατόμων.
Δύναμη
Ιωνικό Οι δεσμοί είναι ο ισχυρότερος τύπος χημικών δεσμών και, ως εκ τούτου, οι περισσότερες ενώσεις παραμένουν στερεές με πολύ υψηλά σημεία τήξης.
Αντίθετα, ομοιοπολικό Οι δεσμοί είναι αρκετά αδύναμοι και ως εκ τούτου οι περισσότερες ενώσεις υπάρχουν στην αέρια φάση.
Ηλεκτρική αγωγιμότητα
Ιωνικό οι ενώσεις γίνονται ένα καλό αγώγιμο μέσο σε υγρή μορφή.
Ομοιοπολικό Οι ενώσεις δεν είναι καλοί ηλεκτρικοί αγωγοί.