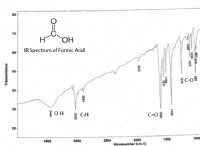
Πώς θα μπορούσε κάποιος να κάνει 2 m λύση της ένωσης;
1. Προσδιορίστε το μοριακό βάρος (MW) της ένωσης
* Μπορείτε να βρείτε αυτές τις πληροφορίες σε ένα χημικό δελτίο δεδομένων ή με τον υπολογισμό του από τον περιοδικό πίνακα.
2. Υπολογίστε τη μάζα που απαιτείται
* Φόρμουλα: Μάζα (γραμμάρια) =μοριακή (m) x όγκος (λίτρα) x μοριακό βάρος (g/mol)
* Παράδειγμα: Για διάλυμα 2 μ. NaCl (μοριακό βάρος =58,44 g/mol) σε 1 λίτρο νερού:
* Μάζα =2 m x 1 l x 58,44 g/mol =116,88 γραμμάρια
3. Διαλύστε την ένωση
* Ζυγίστε την υπολογιζόμενη μάζα της ένωσης.
* Προσθέστε μια μικρή ποσότητα διαλύτη (συνήθως νερό) σε μια ογκομετρική φιάλη.
* Προσθέστε προσεκτικά την ζυγισμένη ένωση στη φιάλη και στροβιλίστε απαλά για να διαλύσετε.
* Μόλις διαλυθεί, προσθέστε περισσότερο διαλύτη στη φιάλη έως ότου το διάλυμα φτάσει στο σήμα βαθμονόμησης στη φιάλη.
* Σταματήστε τη φιάλη και αναστρέψτε αρκετές φορές για να εξασφαλίσετε διεξοδική ανάμιξη.
Σημαντικές εκτιμήσεις:
* Προφυλάξεις ασφαλείας: Πάντα να φοράτε κατάλληλο προσωπικό προστατευτικό εξοπλισμό (PPE) κατά τη διαχείριση των χημικών ουσιών. Συμβουλευτείτε το φύλλο δεδομένων ασφάλειας υλικών (MSDS) για συγκεκριμένους κινδύνους και οδηγίες χειρισμού.
* Διαλυτότητα: Βεβαιωθείτε ότι η ένωση είναι διαλυτή στον διαλύτη που χρησιμοποιείτε. Εάν όχι, ίσως χρειαστεί να ρυθμίσετε τον διαλύτη ή να χρησιμοποιήσετε μια διαφορετική μέθοδο.
* Θερμοκρασία: Η διαλυτότητα των περισσότερων ενώσεων αυξάνεται με τη θερμοκρασία. Εάν εργάζεστε με μια ένωση που έχει περιορισμένη διαλυτότητα σε θερμοκρασία δωματίου, ίσως χρειαστεί να θερμαίνετε το διάλυμα για να το διαλύσετε εντελώς.
* Ακρίβεια: Χρησιμοποιήστε μια αναλυτική ισορροπία για να σταθμίσετε με ακρίβεια την ένωση για ακριβή μοριακή.
* σωστή αποθήκευση: Αποθηκεύστε το διάλυμα σε ένα σφιχτά σφραγισμένο δοχείο που επισημαίνεται με το σύνθετο όνομα, τη συγκέντρωση και την ημερομηνία προετοιμασίας.
Θυμηθείτε: Αυτός είναι ένας γενικός οδηγός. Οι συγκεκριμένες διαδικασίες ενδέχεται να διαφέρουν ανάλογα με την ένωση και τις ιδιότητές της. Συμβουλευτείτε πάντα αξιόπιστες πηγές και ακολουθήστε τις κατάλληλες οδηγίες ασφαλείας.