Πώς ένα άτομο γίνεται θετικό ιόν και αρνητικό ιόν;
θετικά ιόντα (κατιόντα)
* απώλεια ηλεκτρόνων: Ένα θετικό ιόν, ή κατιόν, σχηματίζεται όταν ένα άτομο χάνει * ένα ή περισσότερα ηλεκτρόνια. Αυτή η απώλεια αφήνει το άτομο με περισσότερα πρωτόνια (θετικά φορτισμένα) από τα ηλεκτρόνια (αρνητικά φορτισμένα), με αποτέλεσμα ένα καθαρό θετικό φορτίο.
* Παράδειγμα: Το νάτριο (Na) έχει ένα ηλεκτρόνιο στο εξώτατο κέλυφος του. Χάνει εύκολα αυτό το ηλεκτρόνιο για να γίνει ένα ιόν νατρίου (Na +), το οποίο έχει φορτίο +1.
Αρνητικά ιόντα (Anions)
* Κερδίζοντας ηλεκτρόνια: Ένα αρνητικό ιόν, ή ανιόν, σχηματίζεται όταν ένα άτομο * κερδίζει ένα ή περισσότερα ηλεκτρόνια. Αυτό το κέρδος δημιουργεί μια ανισορροπία με περισσότερα ηλεκτρόνια από τα πρωτόνια, με αποτέλεσμα ένα καθαρό αρνητικό φορτίο.
* Παράδειγμα: Το χλώριο (CL) έχει επτά ηλεκτρόνια στο εξώτατο κέλυφος του. Κερδίζει εύκολα ένα ηλεκτρόνιο για να γίνει ένα ιόν χλωριούχου (cl-), το οποίο έχει φορτίο -1.
Βασικά σημεία:
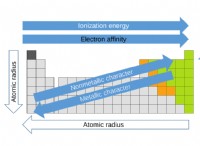
* Ηλεκτροργατιστικότητα: Η τάση ενός ατόμου να προσελκύσει ηλεκτρόνια διαδραματίζει σημαντικό ρόλο στον σχηματισμό ιόντων. Τα στοιχεία με υψηλή ηλεκτροαρνητικότητα (όπως το χλώριο) τείνουν να κερδίζουν ηλεκτρόνια, ενώ εκείνα με χαμηλή ηλεκτροαρνητικότητα (όπως το νάτριο) τείνουν να χάνουν ηλεκτρόνια.
* σταθερότητα: Τα άτομα σχηματίζουν ιόντα για να επιτευχθούν σταθερή διαμόρφωση ηλεκτρονίων (συνήθως ένα πλήρες εξωτερικό κέλυφος ηλεκτρονίων). Με την απώλεια ή την απόκτηση ηλεκτρονίων, μοιάζουν με το πλησιέστερο ευγενές αέριο στον περιοδικό πίνακα, τα οποία είναι εξαιρετικά σταθερά.
* Ιονική σύνδεση: Αντίθετα φορτισμένα ιόντα προσελκύουν ο ένας τον άλλον, σχηματίζοντας ιοντικές ενώσεις. Αυτή η ηλεκτροστατική έλξη είναι η βάση της ιοντικής σύνδεσης.
Συνοπτικά:
Τα άτομα γίνονται θετικά ιόντα χάνοντας ηλεκτρόνια και γίνονται αρνητικά ιόντα κερδίζοντας ηλεκτρόνια. Αυτή η διαδικασία καθοδηγείται από την επιθυμία να επιτευχθεί σταθερή διαμόρφωση ηλεκτρονίων και είναι θεμελιώδης για το σχηματισμό ιοντικών ενώσεων.