Πολικοί εναντίον μη πολικοί δεσμοί και μόρια
Σε αυτό το σεμινάριο χημείας, εξηγούμε τη διαφορά μεταξύ πολικών δεσμών και μη πολικοί δεσμοί . Στη συνέχεια σας λέμε τον ορισμό ενός πολικού μορίου , και τι μη πολικό μόριο είναι. Τελευταίο, αλλά όχι λιγότερο σημαντικό, μαθαίνεις τι δίπολική στιγμή είναι.
Τι σημαίνουν πολικό και μη πολικό;
Με απλά λόγια, πολικό σημαίνει αντίθετα φορτισμένο και μη πολικό ισοδύναμο φορτισμένο. Οι ομοιοπολικοί δεσμοί μπορεί να είναι πολικοί ή μη πολικοί. Για να κατανοήσουμε τη διαφορά μεταξύ πολικών και μη πολικών δεσμών, είναι απαραίτητο να κατανοήσουμε την ηλεκτραρνητικότητα.
Τι είναι η ηλεκτραρνητικότητα;
Η ηλεκτροαρνητικότητα είναι η μέτρηση του πόσο ένα άτομο θέλει να συνδεθεί με ένα άλλο άτομο. Η ηλεκτροαρνητικότητα αυξάνεται από αριστερά προς τα δεξιά και προς τα κάτω κάθε στήλη στον περιοδικό πίνακα. Η κλίμακα Pauling περιγράφει την ηλεκτραρνητικότητα ενός στοιχείου, με κλίμακα από 0,7 έως 4. Το φθόριο είναι το πιο ηλεκτραρνητικό στοιχείο, με ηλεκτραρνητικότητα 4. Το καίσιο είναι το λιγότερο ηλεκτραρνητικό στοιχείο με ηλεκτραρνητικότητα 0,7.
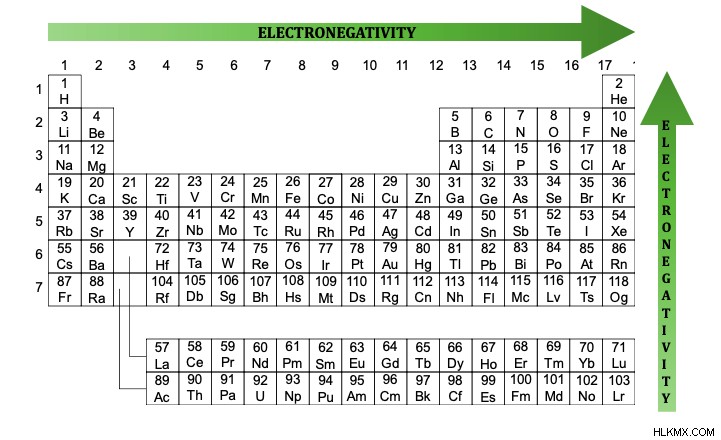
Τι κάνει έναν δεσμό πολικό;
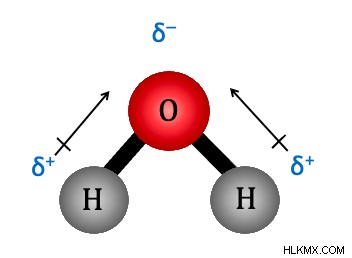
Ένας πολικός δεσμός είναι ένας τύπος ομοιοπολικού δεσμού. Ένας δεσμός μεταξύ δύο ή περισσότερων ατόμων είναι πολικός εάν τα άτομα έχουν σημαντικά διαφορετικές ηλεκτραρνητικότητες (>0,4). Οι πολικοί δεσμοί δεν μοιράζονται τα ηλεκτρόνια εξίσου, που σημαίνει ότι το αρνητικό φορτίο από τα ηλεκτρόνια δεν κατανέμεται ομοιόμορφα στο μόριο. Αυτό προκαλεί μια διπολική στιγμή. Μια διπολική ροπή εμφανίζεται όταν το ένα άκρο του δεσμού είναι θετικό και το άλλο άκρο είναι αρνητικό. Ένα κλασικό παράδειγμα πολικού δεσμού είναι ο δεσμός στο νερό μεταξύ υδρογόνου και οξυγόνου. Ο δεσμός ταξινομείται ως πολικός δεσμός επειδή έχει μεγάλη διαφορά ηλεκτραρνητικότητας 1,4. Τα ηλεκτρόνια στο υδρογόνο έλκονται περισσότερο από τα ηλεκτρόνια στο οξυγόνο επειδή το οξυγόνο είναι πιο ηλεκτραρνητικό.
Τι κάνει έναν δεσμό μη πολικό;
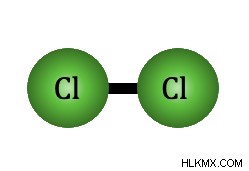
Οι μη πολικοί δεσμοί είναι επίσης ένας τύπος ομοιοπολικού δεσμού. Σε αντίθεση με τους πολικούς δεσμούς, οι μη πολικοί δεσμοί μοιράζονται τα ηλεκτρόνια εξίσου. Ένας δεσμός μεταξύ δύο ή περισσότερων ατόμων είναι μη πολικός εάν τα άτομα έχουν την ίδια ηλεκτραρνητικότητα ή διαφορά ηλεκτραρνητικότητας μικρότερη από 0,4. Ένα παράδειγμα μη πολικού δεσμού είναι ο δεσμός στο χλώριο. Το χλώριο περιέχει δύο άτομα χλωρίου. Τα ηλεκτρόνια μοιράζονται εξίσου επειδή η διαφορά ηλεκτραρνητικότητας μεταξύ των δύο ατόμων είναι μηδέν.
Τι είναι τα πολικά μόρια;
Στη χημεία, ο ορισμός του πολικού μορίου, είναι ένα μόριο που έχει ένα φορτίο στη μία πλευρά του μορίου, το οποίο δεν ακυρώνεται. Διαθέτει περιοχή μερικής φόρτισης. Το ένα άκρο είναι ελαφρώς θετικό το ένα άκρο είναι ελαφρώς αρνητικό. Είναι γενικά ασύμμετρα, με ανομοιόμορφη κατανομή των ηλεκτρονίων.
Τα πολικά μόρια μπορεί να έχουν ιοντικούς ή πολικούς ομοιοπολικούς δεσμούς. Ένα μόριο με δύο πόλους ονομάζεταιδίπολο . Όταν μετράτε την ποσότητα της πολικότητας ενός μορίου, το αποτέλεσμα ονομάζεται διπολική ροπή .
Εάν ένα μόριο είναι μη πολικό, τότε τα μόρια είτε μοιράζονται ομοιόμορφα τα ηλεκτρόνια, π.χ. έχουν μη πολικό δεσμό ή οι πολικοί δεσμοί είναι συμμετρικοί, στις περιπτώσεις του διοξειδίου του άνθρακα ή του τετραχλωράνθρακα. Σε αυτά τα μόρια, υπάρχουν δίπολα αλλά ακυρώνονται λόγω της συμμετρίας.
Τα πολικά μόρια τείνουν να κολλούν μεταξύ τους και να παρατάσσονται σε ομάδες, γεγονός που επηρεάζει τις ιδιότητες πολικών ενώσεων όπως το νερό. Τα μόρια του νερού μπορούν πραγματικά να ευθυγραμμιστούν με την παρουσία μιας ηλεκτροστατικής δύναμης. Επίσης, οι πολικοί διαλύτες τείνουν να διαλύουν τις πολικές διαλυμένες ουσίες και οι μη πολικοί διαλύτες διαλύουν τις μη πολικές διαλυμένες ουσίες.
Παραδείγματα πολικών μορίων
Είναι πολικό το HF;
Ναι, το υδροφθορικό οξύ HF είναι πολικό λόγω της μεγάλης διαφοράς ηλεκτραρνητικότητας μεταξύ υδρογόνου και φθορίου. Το μόριο είναι πολικό ομοιοπολικό.
Είναι το νερό πολικό μόριο;
Ναι, λόγω του λυγισμένου μη συμμετρικού σχήματος του μορίου. Περισσότερα από τα ηλεκτρόνια έλκονται από τα άτομα οξυγόνου, με αποτέλεσμα ένα καθαρό φορτίο.
Είναι η ακετόνη πολική ή μη πολική;
Λόγω της καρβονυλικής ομάδας, η ακετόνη είναι ένα κάπως πολικό μόριο. Υπάρχουν διαφορετικοί βαθμοί πολικότητας και η ακετόνη είναι λιγότερο πολική από το νερό, επειδή μόνο μέρος του μορίου της ακετόνης έχει πολικό δεσμό.
Περισσότερα παραδείγματα πολικών μορίων
Διοξείδιο του θείου SO2 , αμμωνία NH3 , μονοξείδιο του άνθρακα CO, αιθανόλη C2 H5 OH, μεθανόλη CH3 ΟΗ, υδρόθειο H2 S, χλωρομεθάνιο CH3 Cl, όζον O3, τριχλωριούχος φώσφορος (επειδή έχει τριγωνική πυραμιδική γεωμετρία) PCl3
Μη πολικά μόρια
Σε ένα μη πολικό μόριο, δεν σχηματίζονται θετικοί ή αρνητικοί πόλοι στο μόριο. Τυχόν φορτία κατανέμονται ομοιόμορφα σε όλο το μόριο. Τα μη πολικά μόρια είναι γενικά συμμετρικά, όπως το τετραεδρικό μόριο τετραχλωράνθρακα. Ένα άλλο παράδειγμα είναι το τριφθοριούχο βόριο, το οποίο είναι τριγωνικό επίπεδο. Στα συμμετρικά μόρια, τα διπολικά φορτία ακυρώνονται.
Τα μη πολικά μόρια συνήθως διαλύονται καλά σε μη πολικούς διαλύτες, αλλά τείνουν να είναι αδιάλυτα στο νερό.
Παραδείγματα μη πολικών μορίων
Είναι πολικό το διοξείδιο του άνθρακα;
Όχι, CO2 δεν είναι πολικός, παρόλο που οι δεσμοί είναι πολικοί. Λόγω της γραμμικής συμμετρίας του μορίου, τα αρνητικά φορτία γύρω από τα άτομα οξυγόνου ακυρώνονται.
Είναι το HCl πολικό ή μη πολικό;
Επειδή το χλώριο είναι πιο ηλεκτραρνητικό από το υδρογόνο, το υδροχλωρικό οξύ HCl σχηματίζει έναν πολικό δεσμό και επομένως είναι ένα πολικό μόριο. Δεν υπάρχει συμμετρία που θα μπορούσε να ακυρώσει τη διπολική φόρτιση.
Περισσότερα παραδείγματα μη πολικών μορίων
Βενζόλιο C6 H6 , Μεθάνιο CH4 , Τετραχλωριούχος άνθρακας CCl4 , τριφθοριούχο βόριο (επειδή έχει τριγωνική επίπεδη γεωμετρία) BF3 , εξάνιο C6 H14 , άζωτο N2
Ο νέος μας διαδραστικός περιοδικός πίνακας
Ο καλύτερος τρόπος για να δείτε τις ιδιότητες και τις τάσεις των στοιχείων, συμπεριλαμβανομένης της ηλεκτραρνητικότητας, είναι με τον νέο μας εξαιρετικά δροσερό διαδραστικό περιοδικό πίνακα. Έχει καταπληκτικά χρώματα και μπορείτε να δείτε δεκάδες ιδιότητες και να δείτε άρθρα για όλα τα στοιχεία!
Θέματα που καλύπτονται σε άλλα άρθρα
- Ιωνικοί και ομοιοπολικοί δεσμοί
- Μόριο έναντι ένωσης
- Χημεία οξέος-βάσης
- Πολικοί-Ομοιοπολικοί δεσμοί
Καλό βίντεο χημείας που ΔΕΝ αφορά τους πολικούς δεσμούς
Διαβάστε περισσότερα
- Το ιώδιο είναι ένα κοινό πρόσθετο στα φάρμακα λόγω του μη του -πολική ιδιότητα.




