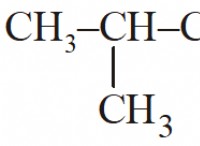Τι χημικό make up σαπούνι;
στοιχεία:
* λιπαρά οξέα: Αυτές είναι μακρές αλυσίδες ατόμων άνθρακα με ομάδα καρβοξυλικού οξέος στο ένα άκρο. Προέρχονται από τα λίπη ή τα έλαια που χρησιμοποιούνται στην σαπουνάδα. Παραδείγματα περιλαμβάνουν στεατικό οξύ, ελαϊκό οξύ και παλμιτικό οξύ.
* Αλκαλικό: Αυτή είναι μια ισχυρή βάση, τυπικά υδροξείδιο του νατρίου (ΝΑΟΗ) ή υδροξείδιο του καλίου (ΚΟΗ). Καταστρέφει τα λίπη σε γλυκερόλη και άλατα λιπαρών οξέων.
* γλυκερόλη: Αυτό είναι ένα υποπροϊόν της διαδικασίας σαπωνοποίησης. Είναι ένα απλό πολυόλης με γλυκιά γεύση.
* νερό: Το νερό είναι απαραίτητο για την εμφάνιση της αντίδρασης και βοηθά στη διάλυση του αλκαλίου.
Χημική αντίδραση:
Η χημική αντίδραση μεταξύ του λίπους και του αλκάλου παράγει σαπούνι, το οποίο είναι το άλας του λιπαρού οξέος. Η γενική εξίσωση είναι:
λίπος + αλκαλί → σαπούνι + γλυκερόλη
Παράδειγμα:
* λίπος: Τριγλυκερίδιο (όπως το ελαιόλαδο)
* Αλκαλικό: Υδροξείδιο νατρίου (NaOH)
* σαπούνι: Λαϊκό νατρίου (από ελαιόλαδο)
* γλυκερόλη: Γλυκερόλη
Βασικά σημεία:
* Ο τύπος λίπους ή πετρελαίου που χρησιμοποιείται θα καθορίσει τις ιδιότητες του σαπουνιού.
* Ο τύπος των χρησιμοποιούμενων αλκαλίων θα επηρεάσει επίσης τις ιδιότητες του σαπουνιού (π.χ. υδροξείδιο του νατρίου κάνει σκληρό σαπούνι ράβδου, ενώ το υδροξείδιο του καλίου κάνει μαλακότερο, υγρό σαπούνι).
* Τα μόρια σαπουνιού έχουν μια πολική κεφαλή (υδρόφιλη, προσελκύονται από το νερό) και μια μη πολική ουρά (υδρόφοβη, απωθημένη από νερό). Αυτή η δομή επιτρέπει στο σαπούνι να καθαριστεί με γαλακτωματοποιώντας γράσο και βρωμιά, καθιστώντας τα διαλυτά στο νερό.
Σημείωση:
Αυτή η εξήγηση επικεντρώνεται στο παραδοσιακό, σπιτικό σαπούνι. Τα εμπορικά σαπούνια ενδέχεται να περιέχουν πρόσθετα όπως αρώματα, βαφές και συντηρητικά.