Διαφορά μεταξύ υδρόφοβων και υδρόφιλων μορίων
Κύρια διαφορά – Υδροφοβικά έναντι υδρόφιλων μορίων
Το νερό είναι ένας πολύ γνωστός διαλύτης για τη διάλυση των περισσότερων από τις ενώσεις που γνωρίζουμε. Αλλά όλες οι ενώσεις στη φύση δεν αναμειγνύονται με το νερό. Οι ουσίες που μπορούν να αναμειχθούν με το νερό ονομάζονται υδρόφιλες ουσίες. Οι ουσίες που δεν μπορούν να αναμειχθούν με το νερό είναι γνωστές υδρόφοβες ουσίες. Αυτό συμβαίνει κυρίως λόγω της πολικότητας των μορίων του νερού. Οι μη πολικές ενώσεις δεν μπορούν να διαλυθούν σε έναν πολικό διαλύτη. Εδώ, θα πρέπει να εξετάσουμε το γεγονός «το όμοιο διαλύει το όμοιο». Οι πολικές ενώσεις μπορούν να διαλυθούν σε πολικούς διαλύτες. Οι μη πολικές ενώσεις διαλύονται σε μη πολικούς διαλύτες. Επομένως, οι υδρόφιλες ουσίες θα πρέπει να είναι πολικές για να διαλύονται στο νερό. Η κύρια διαφορά μεταξύ υδρόφοβων και υδρόφιλων μορίων είναι ότι τα υδρόφοβα μόρια είναι μη πολικά ενώ τα υδρόφιλα μόρια είναι πολικά.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα υδρόφοβα μόρια
– Ορισμός, ιδιότητες και παραδείγματα
2. Τι είναι τα υδρόφιλα μόρια
– Ορισμός, ιδιότητες και παραδείγματα
3. Ποια είναι η διαφορά μεταξύ υδρόφοβων και υδρόφιλων μορίων
– Σύγκριση βασικών διαφορών
Βασικοί όροι:υδρόφιλο, υδρόφιλο, υδρόφοβο, υδρόφοβο, μη πολικό, πολικό, νερό 
Τι είναι τα υδρόφοβα μόρια
Τα υδρόφοβα μόρια είναι μόρια που δεν διαλύονται στο νερό. Επομένως, αυτά τα μόρια απωθούν τα μόρια του νερού. Αυτά τα υδρόφοβα μόρια ονομάζονται υδρόφοβα . Η υδροφοβικότητα περιγράφει πόσο υδρόφοβο είναι ένα μόριο.
Τα υδρόφοβα μόρια είναι υδρόφοβα λόγω της μη πολικότητας τους. Με άλλα λόγια, τα υδρόφοβα μόρια είναι μη πολικά. Επομένως, τα υδρόφοβα μόρια αποτελούνται συχνά από ομάδες υδρογονανθράκων μακράς αλυσίδας που μπορούν να κάνουν ένα μόριο μη πολικό.

Εικόνα 1:Υδροφοβικό
Όταν προστίθενται υδρόφοβα μόρια στο νερό, αυτά τα μόρια τείνουν να σχηματίζουν μικκύλια, τα οποία μοιάζουν με συστάδες, προκειμένου να έχουν ελάχιστη επαφή με το νερό. Ωστόσο, το μόριο του νερού τοποθετείται γύρω από αυτές τις συστάδες για να σχηματίσει ένα κλουβί. Όταν σχηματίζεται αυτή η συστάδα, οι δεσμοί υδρογόνου μεταξύ των μορίων του νερού διασπώνται, δημιουργώντας χώρο για τη συστάδα. Αυτή είναι μια ενδόθερμη αντίδραση αφού οι χημικοί δεσμοί διασπώνται. Επιπλέον, ο σχηματισμός συστάδων προκαλεί μείωση της εντροπίας του συστήματος.
Σύμφωνα με τις θερμοδυναμικές σχέσεις,
ΔG = ΔH – TΔS
Όπου ΔG είναι η ελεύθερη ενέργεια Gibbs
ΔH είναι η μεταβολή της ενθαλπίας
T είναι η θερμοκρασία
ΔS είναι η αλλαγή στην εντροπία.
Όταν προστίθενται υδρόφοβα μόρια στο νερό, το ΔS μειώνεται. Επομένως, η τιμή του TΔS μειώνεται. Δεδομένου ότι είναι μια ενδόθερμη αντίδραση, η ΔΗ είναι μια θετική τιμή. Επομένως, η τιμή του ΔG θα πρέπει να είναι μια μεγάλη θετική τιμή. Μια θετική τιμή ΔG δείχνει ότι η αντίδραση δεν είναι αυθόρμητη. Ως εκ τούτου, η διάλυση υδρόφοβων μορίων στο νερό είναι μη αυθόρμητη.
Οι αλληλεπιδράσεις που συμβαίνουν μεταξύ υδρόφοβων μορίων είναι αλληλεπιδράσεις Van Der Waal δεδομένου ότι είναι μη πολικά μόρια. Αυτές οι αλληλεπιδράσεις έχουν ένα συγκεκριμένο όνομα:υδρόφοβες αλληλεπιδράσεις. Οι μάζες που υπάρχουν στο νερό τείνουν να αλληλεπιδρούν και να αναμιγνύονται μεταξύ τους προκειμένου να ελαχιστοποιηθεί περαιτέρω η επαφή με το νερό. Η αλλαγή στην ενθαλπία για αυτή την αντίδραση είναι θετική τιμή, καθώς οι δεσμοί υδρογόνου μεταξύ των μορίων του νερού που περιβάλλουν τις συστάδες διασπώνται. Η εντροπία του συστήματος αυξάνεται αφού τα κλουβιά στα οποία βρίσκονταν οι συστάδες διασπώνται για να απελευθερωθούν υδρόφοβοι. Όταν ληφθεί υπόψη η συνολική διαδικασία, η τιμή ΔG παίρνει μια αρνητική τιμή. Επομένως, ο σχηματισμός των υδρόφοβων δεσμών είναι αυθόρμητος.
Τι είναι τα υδρόφιλα μόρια
Τα υδρόφιλα μόρια είναι μόρια που μπορούν να διαλυθούν στο νερό. Δηλαδή, τα υδρόφιλα μόρια προσελκύουν μόρια νερού. Ο υδρόφιλος χαρακτήρας ενός μορίου μπορεί να περιγραφεί ως η υδροφιλία του. Τα υδρόφιλα μόρια είναι πολικά μόρια. Τα μόρια του νερού είναι πολικά μόρια, τα οποία επιτρέπουν στα πολικά μόρια να διαλυθούν στο νερό. Αυτά τα υδρόφιλα μόρια ονομάζονται υδρόφιλα .
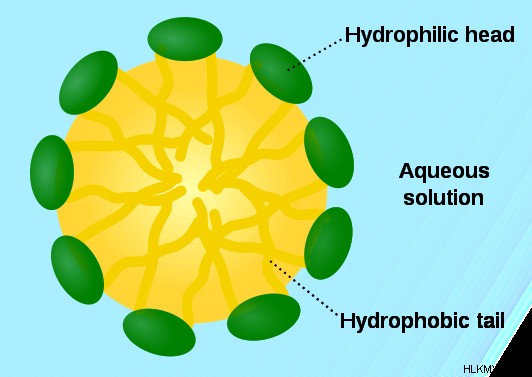
Εικόνα 1:Σχηματισμός μικκυλίων. Εδώ, το υδρόφιλο τμήμα κατευθύνεται προς τα έξω γιατί το υδρόφιλο τμήμα έλκει νερό.
Τα υδρόφιλα μόρια μπορούν να σχηματίσουν χημικούς δεσμούς με μόρια νερού. Εάν αυτά τα υδρόφιλα μόρια αποτελούνται από δεσμούς τύπου Ο-Η, Ν-Η, μπορούν να σχηματίσουν δεσμούς υδρογόνου με μόρια νερού και στη συνέχεια να αναμειχθούν με νερό. Σύμφωνα με τις θερμοδυναμικές σχέσεις,
ΔG = ΔH – TΔS
Η εντροπία του συστήματος αυξάνεται λόγω της ανάμειξης των υδρόφιλων μορίων με το νερό και τότε η μεταβολή της εντροπίας ΔS είναι θετική τιμή. Δεδομένου ότι δημιουργούνται νέοι δεσμοί μεταξύ υδρόφιλων και μορίων νερού, αυτή η ανάμειξη είναι εξώθερμη. Τότε η μεταβολή της ενθαλπίας είναι αρνητική τιμή. Επομένως, η ελεύθερη ενέργεια Gibbs είναι μια αρνητική τιμή που υποδεικνύει ότι η ανάμειξη είναι αυθόρμητη.
Η υδροφιλία των υδρόφιλων καθορίζει πόσο καλά αυτά τα μόρια θα διαλυθούν στο νερό. Η πολικότητα των μορίων προκύπτει λόγω των διαφορών μεταξύ των τιμών ηλεκτραρνητικότητας των ατόμων στους χημικούς δεσμούς. Όσο μεγαλύτερη είναι η διαφορά, τόσο μεγαλύτερη είναι η πολικότητα. τότε, υψηλότερη η υδροφιλικότητα.
Διαφορά μεταξύ υδρόφοβων και υδρόφιλων μορίων
Ορισμός
Υδρόφοβο Μόρια: Τα υδρόφοβα μόρια είναι μόρια που δεν διαλύονται στο νερό.
Υδρόφιλα μόρια: Τα υδρόφιλα μόρια είναι μόρια που μπορούν να διαλυθούν στο νερό.
Άλλα ονόματα
Υδρόφοβο Μόρια: Τα υδρόφοβα μόρια ονομάζονται υδρόφοβα.
Υδρόφιλα μόρια: Τα υδρόφιλα μόρια ονομάζονται υδρόφιλα.
Αλληλεπίδραση με το νερό
Υδρόφοβο Μόρια: Τα υδρόφοβα μόρια απωθούν τα μόρια του νερού.
Υδρόφιλα μόρια: Τα υδρόφιλα μόρια προσελκύουν μόρια νερού.
Πολικότητα
Υδρόφοβο Μόρια: Τα υδρόφοβα μόρια είναι μη πολικά.
Υδρόφιλα μόρια: Τα υδρόφιλα μόρια είναι πολικά.
Gibbs Free Energy
Υδροφοβικό Μόρια: Όταν προστίθενται υδρόφοβα μόρια στο νερό, η ελεύθερη ενέργεια Gibbs παίρνει θετική τιμή.
Υδρόφιλα μόρια: Όταν προστίθενται υδρόφιλα μόρια στο νερό, η ελεύθερη ενέργεια Gibbs παίρνει αρνητική τιμή.
Αλλαγή στην Εντροπία
Υδρόφοβο Μόρια: Όταν προστίθενται υδρόφοβα μόρια στο νερό, η εντροπία μειώνεται.
Υδρόφιλα μόρια: Όταν προστίθενται υδρόφιλα μόρια στο νερό, η εντροπία αυξάνεται.
Τύπος αντίδρασης
Υδρόφοβο Μόρια: Η διάλυση υδρόφοβων μορίων στο νερό είναι μια ενδόθερμη αντίδραση.
Υδρόφιλα μόρια: Η διάλυση υδρόφιλων μορίων στο νερό είναι μια εξώθερμη αντίδραση.
Συμπέρασμα
Τα μόρια μπορούν να κατηγοριοποιηθούν ως υδρόφοβα μόρια ή υδρόφιλα μόρια ανάλογα με την απόκριση που δείχνουν αυτά τα μόρια στα μόρια του νερού. Τα υδρόφοβα μόρια απωθούν τα μόρια του νερού. Τα υδρόφιλα μόρια προσελκύουν μόρια νερού. Ωστόσο, η βασική διαφορά μεταξύ υδρόφοβων και υδρόφιλων μορίων είναι ότι τα υδρόφοβα μόρια είναι μη πολικά ενώ τα υδρόφιλα μόρια είναι πολικά.