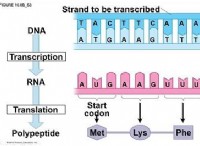
Τα ηλεκτρόνια κερδίζουν ιώδιο σε χημική αλλαγή;
* Διαμόρφωση ηλεκτρονίων του ιωδίου: Το ιώδιο έχει 7 ηλεκτρόνια στο εξωτερικό κέλυφος του. Θέλει να έχει ένα πλήρες εξωτερικό κέλυφος 8 ηλεκτρονίων για σταθερότητα.
* Κερδίζοντας ηλεκτρόνια: Για να επιτευχθεί αυτή η σταθερότητα, το ιώδιο τείνει να κερδίσει ένα ηλεκτρόνιο, να γίνει ιόν ιωδίου (i⁻). Αυτή η διαδικασία ονομάζεται μείωση .
* Παράδειγμα: Στην αντίδραση μεταξύ νατρίου (Na) και ιωδίου (i₂), το νάτριο χάνει ένα ηλεκτρόνιο για να γίνει ένα ιόν νατρίου (Na⁺), ενώ το ιώδιο κερδίζει ένα ηλεκτρόνιο για να γίνει ιόν ιωδιδίου (i⁻). Αυτό σχηματίζει ιωδιούχο νάτριο (NAI).
Βασικό σημείο: Η τάση του ιωδίου να κερδίσει ηλεκτρόνια είναι αυτό που το καθιστά αλογόνο , μια ομάδα εξαιρετικά αντιδραστικών μη μετάλλων που σχηματίζουν εύκολα αρνητικά ιόντα.