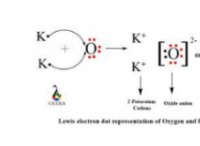
Τι συμβαίνει με τα μόρια της διαλυμένης ουσίας κατά τη διαδικασία διάλυσης;
1. Έλξη και διαχωρισμός:
* Αξιοθέατα διαλυτής διαλυτής ουσίας: Τα μόρια της διαλελυμένης ουσίας συγκρατούνται από δυνάμεις όπως οι ιοντικοί δεσμοί, οι δεσμοί υδρογόνου ή οι δυνάμεις van der Waals.
* Αξιοθέατα διαλύτη διαλύτη: Τα μόρια διαλύτη έχουν επίσης τις δικές τους ελκυστικές δυνάμεις.
* Αξιοθέατα διαλυτή διαλύτη: Όταν η διαλυμένη ουσία και ο διαλύτης αναμειγνύονται, τα μόρια διαλύτη αρχίζουν να αλληλεπιδρούν με τα μόρια διαλυμένης ουσίας. Εάν η έλξη μεταξύ των μορίων διαλυμένης ουσίας και διαλύτη είναι ισχυρότερη από τα αξιοθέατα διαλυτής διαλυτής ουσίας, η διαλελυμένη διαλύτη θα αρχίσει να διαλύεται.
2. Διάλυση:
* Σπάσιμο: Τα μόρια του διαλύτη περιβάλλουν τα μόρια διαλυμένης ουσίας, διαχωρίζοντάς τα αποτελεσματικά το ένα από το άλλο.
* Νέες αλληλεπιδράσεις: Τα μόρια του διαλύτη σχηματίζουν νέα αξιοθέατα με τα μόρια διαλυμένης ουσίας, δημιουργώντας μια διαλυμένη κατάσταση. Αυτή η διαδικασία ονομάζεται μερικές φορές ενυδάτωση όταν ο διαλύτης είναι νερό.
3. Διάλυση:
* Διασπορά: Τα μόρια διαλυμένης ουσίας κατανέμονται ομοιόμορφα σε όλο τον διαλύτη. Αυτό σημαίνει ότι δεν είναι πλέον συγκεντρωμένα μαζί αλλά περιβάλλονται από μόρια διαλύτη.
* Σχηματισμός λύσης: Το αποτέλεσμα είναι ένα ομοιογενές μίγμα, όπου η διαλυμένη ουσία είναι ομοιόμορφα διασκορπισμένη στον διαλύτη.
Σημαντικά σημεία:
* Διαλυτότητα: Δεν είναι όλες οι διαλυμένες ουσίες να διαλύονται εξίσου καλά σε όλους τους διαλύτες. Η αντοχή των αξιοθέατων διαλυτών διαλυτών σε σύγκριση με τα αξιοθέατα διαλυτής διαλυτής και διαλύτη διαλύτη καθορίζει τη διαλυτότητα.
* "Όπως διαλύεται όπως": Οι διαλυτές τείνουν να διαλύονται καλύτερα σε διαλύτες με παρόμοιες πολικότητες. Για παράδειγμα, οι πολικές διαλυμένες ουσίες (όπως η ζάχαρη) διαλύονται καλά σε πολικούς διαλύτες (όπως το νερό), ενώ οι μη πολικές διαλυμένες ουσίες (όπως το πετρέλαιο) διαλύονται καλά σε μη πολικούς διαλύτες (όπως η βενζίνη).
αναλογία: Φανταστείτε να βάζετε αλάτι στο νερό. Τα μόρια του νερού τραβούν τα ιόντα άλατος χωριστά, γύρω από τα και εμποδίζοντας τους από το να συσσωρεύονται μαζί. Αυτό δημιουργεί μια λύση όπου το αλάτι κατανέμεται ομοιόμορφα σε όλο το νερό.