Οξείδιο του καλίου:Δομή, τύπος, ιδιότητες &χρήσεις
Γνωρίζετε μετά το νάτριο ποιο είναι το πιο δραστικό μέταλλο; Οχι? Είναι κάλιο! Το κάλιο είναι σαν το νάτριο, δηλαδή πολύ αντιδραστικό, μαλακό και σφριγηλό. Λόγω της αντιδραστικότητάς του, διατηρείται σε κηροζίνη. Παρόμοια με το νάτριο, το κάλιο επίσης αντιδρά με το οξυγόνο και σχηματίζει οξείδιο του καλίου. Μπορείτε όμως να απαντήσετε, είναι το οξείδιο του καλίου ιοντικό ή ομοιοπολικό; Είναι αυτή η ένωση όξινη ή βασική; Ποιες είναι οι εφαρμογές του οξειδίου του καλίου;
Αυτή η ενότητα θα σας επιτρέψει να λύσετε όλα αυτά τα ερωτήματα σχετικά με το οξείδιο του καλίου.
Τι είναι το οξείδιο του καλίου;
Το οξείδιο του καλίου είναι μια ένωση που σχηματίζεται από τη σύνδεση μεταξύ οξυγόνου και καλίου. Είναι επίσης γνωστό ως οξείδιο του δικαλίου ή μονοξείδιο του καλίου. Είναι μια ανόργανη ένωση. Όπως το οξείδιο του νατρίου, το οξείδιο του καλίου είναι επίσης μια εξαιρετικά δραστική και σπάνια ένωση.
Είναι εύκολο να μαντέψει κανείς εάν το οξείδιο του καλίου είναι ιοντικό ή ομοιοπολικό. Πρώτον, το κάλιο είναι μέταλλο και τα μέταλλα είναι ηλεκτροθετικά, ενώ το οξυγόνο είναι ένα από τα εξαιρετικά ηλεκτραρνητικά στοιχεία. Έτσι, συμβαίνει πόλωση και η ένωση που σχηματίζεται είναι ιοντική.
Δεύτερον, εξηγείται από τη δομή του οξειδίου του καλίου Lewis, η οποία εξηγείται περαιτέρω.
Δομή και τύπος οξειδίου του καλίου
Ο μοριακός τύπος του οξειδίου του καλίου είναι K2O. Σε γενικές γραμμές, το οξείδιο του καλίου ονομάζεται οξείδιο αλκαλιμετάλλου. Είναι η απλούστερη ένωση του καλίου που είναι εξαιρετικά δραστική.
Αυτή η ένωση είναι μια ιοντική ένωση. Είναι επειδή το κάλιο έχει μόνο ένα ηλεκτρόνιο στο εξωτερικό του περίβλημα και το οξυγόνο έχει έλλειψη από δύο ηλεκτρόνια για να αποκτήσει μια ολοκληρωμένη οκτάδα. Ως εκ τούτου, δύο άτομα καλίου θα δωρίσουν τα ηλεκτρόνια τους στο άτομο οξυγόνου και θα σχηματίσουν ιοντικούς δεσμούς. Ως αποτέλεσμα, η σύνθετη μορφή είναι επίσης ιοντική.
Η δομή Lewis του οξειδίου του καλίου δίνεται παρακάτω:
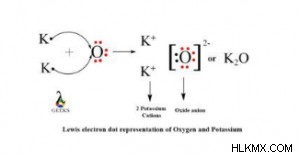
Το ιόν καλίου έχει φορτίο +1, ενώ το ιόν οξυγόνου έχει φορτίο -2. Για μια ηλεκτρικά ουδέτερη ένωση, τα φορτία πρέπει να αντισταθμίζουν το ένα το άλλο. Επομένως, απαιτούνται δύο άτομα Κ για να εξισορροπηθεί το φορτίο -2 στο άτομο Ο. Ως αποτέλεσμα, ο τύπος για το οξείδιο του καλίου είναι K2O.
Παρασκευή οξειδίου του καλίου
Μερικές μέθοδοι για την παρασκευή οξειδίου του καλίου είναι
1. Με τη βοήθεια υπεροξειδίου του καλίου:
- Το προϊόν που λαμβάνεται είναι οξείδιο του καλίου κατά την αντίδραση υπεροξειδίου του καλίου, δηλ. K2O2, με μέταλλο καλίου.
K2O2 + 2K → 2K2O
- Κατά τη θέρμανση του υπεροξειδίου του καλίου στους 500°C, αποσυντίθεται σε καθαρό οξείδιο του καλίου και μόρια οξυγόνου.
2K2O2 → 2K2O + O2 ↑
2. Με τη βοήθεια του νιτρικού καλίου:
Όταν το νιτρικό κάλιο υποβάλλεται σε επεξεργασία με μέταλλο καλίου, δίνει οξείδιο του καλίου με την απελευθέρωση αερίου αζώτου. Αυτή η μέθοδος είναι πιο ευνοϊκή από την πρώτη.
2KNO3 + 10K → 6K2O + N2 ↑
3. Με τη βοήθεια υδροξειδίου του καλίου:
Το υδροξείδιο του καλίου δεν μπορεί να αφυδατωθεί περαιτέρω προς το οξείδιο. Αλλά μπορεί να αντιδράσει με τηγμένο κάλιο για να παράγει οξείδιο του καλίου και να απελευθερώσει υδρογόνο ως υποπροϊόν.
2KOH + 2K ⇌ 2K2O + H2 ↑
4. Με τη βοήθεια μεταλλικού καλίου:
Όταν το μέταλλο καλίου αντιδρά με το οξυγόνο, δίνει οξείδιο του καλίου. Αυτή η αντίδραση αναπαρίσταται ως
4K + O2 → 2K2O
Φυσικές ιδιότητες του οξειδίου του καλίου
Το κάλιο είναι μέλος της οικογένειας του νατρίου, δηλαδή της ομάδας Ι στον περιοδικό πίνακα. Τείνει να ολοκληρώσει την οκτάδα του απελευθερώνοντας ηλεκτρόνια. Ως εκ τούτου, είναι εξαιρετικά αντιδραστικό στην ελεύθερη μορφή του. Όταν υποβάλλεται σε επεξεργασία με οξυγόνο, δημιουργεί εύκολα δεσμό με το άτομο Ο και σχηματίζει οξείδιο του καλίου. Μερικές φυσικές ιδιότητες του οξειδίου του καλίου είναι:
- Είναι μια κρυσταλλική και στερεή ένωση ανοιχτού κίτρινου ή λευκού χρώματος.
- Η μοριακή μάζα του οξειδίου του καλίου είναι 94,2 g/mol.
- Χρησιμοποιείται ευρέως ως λίπασμα.
- Είναι πιο πυκνό από το νερό. Και η πυκνότητα του οξειδίου του καλίου είναι 2,35 gm/cm³.
- Είναι μια άοσμη ένωση.
- Αποσυντίθεται στους 740°C.
- Είναι διαλυτό σε αιθανόλη και διαιθυλαιθέρα.
- Η θερμοχωρητικότητα του οξειδίου του καλίου είναι 83,62 J/mol·K.
- Τα μόρια του οξειδίου του καλίου σχηματίζουν μια αντιφθοριτική δομή.
Χημικές ιδιότητες του οξειδίου του καλίου
Οι χημικές ιδιότητες μιας ένωσης είναι οι ιδιότητες που αλλάζουν τη χημική σύνθεση της ένωσης. Δεδομένου ότι το κάλιο είναι ένα μέταλλο υψηλής αντίδρασης, το οξείδιο του καλίου είναι μια δραστική ένωση και μπορεί να αντιδράσει έντονα.
- Η αντίδραση του οξειδίου του καλίου με την περίσσεια νερού γίνεται έντονα διαβρωτική και η ένωση σχηματίζει υδροξείδιο του καλίου.
K2O + H2O → KOH
- Είναι ένα οξείδιο μετάλλου και γενικά, τα οξείδια μετάλλων είναι βασικά. Επομένως, είναι βασικό ή αλκαλικό και είναι πολύ διαβρωτικό.
- Όταν το οξείδιο του καλίου αντιδρά με ισχυρά οξέα, δίνει αλάτι και νερό. Αυτή η αντίδραση δείχνει ότι το οξείδιο του καλίου είναι μια βασική ένωση.
K2O + HCl → KCl + H2O
K2O + H2SO4 → K2SO4 + H2O
K2O + HNO3 → 2KNO3 + H2O
Αυτές οι αντιδράσεις είναι παραδείγματα αντιδράσεων εξουδετέρωσης.
- Όταν θερμαίνεται πάνω από 300°C, το οξείδιο του καλίου μετατρέπεται σε υπεροξείδιο του καλίου και μέταλλο καλίου.
2K2O → K2O2 + 2K
Χρήσεις και εφαρμογές του οξειδίου του καλίου
Είναι πολύ σφριγηλό και αντιδρά εύκολα με την υγρασία. Χρησιμοποιείται για διάφορους σκοπούς. Μερικά από αυτά είναι
- Στη γεωργική βιομηχανία, το οξείδιο του καλίου χρησιμοποιείται ευρέως ως λίπασμα.
- Χρησιμοποιείται επίσης σε συνθέσεις γυαλιού και στη βιομηχανία παραγωγής τσιμέντου.
- Το οξείδιο του καλίου είναι αδιάλυτο στο νερό και είναι μια πολύ σταθερή ένωση. Αυτή η ιδιότητα το καθιστά εύχρηστο στη βιομηχανία κεραμικών.
- Χρησιμοποιείται από γιατρούς ζώων για τη θεραπεία ασθενειών που σχετίζονται με ζώα.
- Γενικά, είναι γνωστή ως καθαρή ποτάσα και χρησιμοποιείται στην παρασκευή ποτηριών και σαπουνιών.
- Στην αεροδιαστημική βιομηχανία, το οξείδιο του καλίου χρησιμοποιείται για την κατασκευή δομικών ενώσεων και ελαφρών μπολ.
- Όπως οι ζυγομύκητες κ.λπ., οι μυκητιάσεις, το οξείδιο του καλίου χρησιμοποιείται για τη θεραπεία τέτοιων λοιμώξεων.
- Σε μικρές ποσότητες, το οξείδιο του καλίου χρησιμοποιείται επίσης σε ορισμένα φάρμακα.
Μέτρα ασφαλείας για τη χρήση οξειδίου του καλίου
Το οξείδιο του καλίου είναι χρήσιμο για διάφορους σκοπούς, αλλά η εξαιρετικά δραστική του φύση το καθιστά επικίνδυνο χημικό. Επομένως, είναι απαραίτητο να λαμβάνετε προφυλάξεις κατά την εργασία με αυτό. Ωστόσο, εάν έρθετε σε επαφή με το οξείδιο του καλίου με κάποιο τρόπο, πρέπει να λάβετε άμεσα μέτρα πρώτων βοηθειών. Αυτά είναι
1. Εάν τα μάτια σας έρθουν σε επαφή με οξείδιο του καλίου:
- Ξπλύνετε αμέσως τα μάτια σας με μεγάλη ποσότητα νερού για τουλάχιστον 30 λεπτά.
- Πλύντε τα μάτια σας σηκώνοντας τα βλέφαρά σας πάνω-κάτω.
- Όταν πλένετε τα μάτια σας, εάν φοράτε φακούς επαφής, αφαιρέστε τους.
- Ζητήστε αμέσως ιατρική βοήθεια.
2. Εάν το δέρμα σας έρθει σε επαφή με οξείδιο του καλίου:
- Αφαιρέστε όλα τα μολυσμένα ρούχα όσο το δυνατόν γρηγορότερα.
- Πλύντε αμέσως τη μολυσμένη περιοχή σας με μεγάλη ποσότητα νερού.
- Ζητήστε αμέσως ιατρική βοήθεια.
3. Εάν έχετε εισπνεύσει οξείδιο του καλίου:
- Αφαιρέστε το άτομο που εκτέθηκε σε οξείδιο του καλίου από τη θέση του.
- Ξεκινήστε τις πρώτες βοήθειες δίνοντάς του μια σωτήρια αναπνοή εάν έχει σταματήσει η αναπνοή του.
- Εάν η καρδιά του έχει σταματήσει να λειτουργεί, δώστε του ΚΑΡΠΑ.
- Γρήγορη μεταφορά στην ιατρική μονάδα.
Συμπέρασμα
Αφού διαβάσετε το παραπάνω άρθρο, είστε πλέον καλά ενημερωμένοι για το οξείδιο του καλίου. Το οξείδιο του καλίου είναι ένα ανόργανο οξύ με μια ιδιαίτερα δραστική χαρακτηριστική ιδιότητα. Ο τύπος του οξειδίου του καλίου είναι K2O. Έχει βασική ή αλκαλική φύση. Δίνει αντιδράσεις εξουδετέρωσης όταν υποβάλλεται σε επεξεργασία με ισχυρά οξέα. Λόγω των διαφορετικών ιδιοτήτων του, χρησιμοποιείται κυρίως ως λίπασμα στη γεωργία. Είναι χρήσιμο στη βιομηχανία γυαλιού, κεραμικής και οπτικής. Γίνεται τοξικό κατά την κατάποση και την εισπνοή. Λόγω της τοξικής φύσης του, είναι απαραίτητο να λαμβάνετε προφυλάξεις κατά την εργασία με αυτό.
Συχνές ερωτήσεις
1. Πόσους τύπους οξειδίων σχηματίζει το κάλιο όταν εκτίθεται στον αέρα;
Α. Όταν το κάλιο εκτίθεται στον αέρα (δηλαδή στο οξυγόνο), σχηματίζει τρεις τύπους οξειδίων. Ο σχηματισμός οξειδίου εξαρτάται από τη διαθεσιμότητα οξυγόνου κατά τη διάρκεια της αντίδρασης.
- Οξείδιο του καλίου, K2O
- Υπεροξείδιο του καλίου, K2O2
- Υπεροξείδιο του καλίου, KO2
Η αντίδραση λαμβάνει χώρα ως
8K + 4O2 → 2K2O+ 2KO2 + K2O2
2. Τι είναι το υπεροξείδιο του καλίου;
Α. Το υπεροξείδιο του καλίου είναι μια ανόργανη ένωση με τον χημικό τύπο KO2. Η κατάσταση οξείδωσης του οξυγόνου σε KO2, υπεροξείδιο του καλίου, είναι -1. Είναι ένα κίτρινο παραμαγνητικό στερεό που αποσυντίθεται στον υγρό αέρα. Έχει διαφορετικές χημικές και φυσικές ιδιότητες από το οξείδιο του καλίου ή το υπεροξείδιο του καλίου.
3. Το οξείδιο του καλίου προκαλεί κινδύνους για την υγεία;
Α. Το οξείδιο του καλίου είναι μια ανόργανη ένωση με χημικό τύπο K2O. Είναι πολύ διαβρωτικό και ισχυρό στην υγρασία και τον αέρα. Επομένως, ο χειρισμός του με προσοχή και ασφάλεια είναι απαραίτητος κατά τη διάρκεια χημικών αντιδράσεων ή κατά την εργασία με αυτό. Μερικοί κίνδυνοι για την υγεία που προκαλούνται από το οξείδιο του καλίου είναι
- Εάν έρθει σε επαφή με το δέρμα, μπορεί να προκαλέσει ερεθισμό του δέρματος.
- Εάν εισέλθει το οξείδιο του καλίου στα μάτια σας, μπορεί να βλάψει σοβαρά τα μάτια.
- Όταν εισπνέεται, μπορεί να προκαλέσει βήχα και δύσπνοια.
- Κατά την εισπνοή, μπορεί να ερεθίσει τη μύτη, το λαιμό και τους πνεύμονες.
Επομένως, είναι απαραίτητο να φοράτε γάντια, παλτά εργαστηρίου και γυαλιά ασφαλείας ενώ εργάζεστε στο εργαστήριο με οξείδιο του καλίου.
4. Όταν το οξείδιο του καλίου διαλύεται στο νερό, ποιο είναι το pH του διαλύματος που σχηματίζεται;
Α. Το οξείδιο του καλίου είναι μια ιοντική ένωση, και έχει βασική φύση. Όταν διαλύεται στο νερό, διασπάται πλήρως σε ιόντα K+ και OH-. Η συγκέντρωση των ιόντων [ΟΗ-] χρησιμοποιείται για τον υπολογισμό του pH του διαλύματος.
pH =14 – pOH
pH =14 – 1,48 =12,52
Επομένως, το pH του διαλύματος που σχηματίζεται θα είναι 12,52.