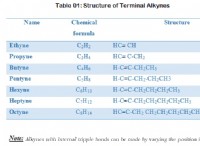
Ποια είναι η χαμηλότερη συγκέντρωση ιόντων υδρονίου;
Εδώ είναι γιατί:
* Αυτοεγοίματα του νερού: Τα μόρια του νερού μπορούν να αντιδράσουν μεταξύ τους, με αποτέλεσμα το σχηματισμό μιας μικρής ποσότητας ιόντων υδρονίου (H₃O⁺) και ιόντων υδροξειδίου (OH⁻). Αυτή η διαδικασία ονομάζεται αυτοιονισμός:
* 2H₂O (l) ⇌ h₃o⁺ (aq) + oh (aq)
* σταθερά ισορροπίας: Η σταθερά ισορροπίας για αυτή την αντίδραση, KW, είναι 1,0 x 10⁻⁻ στους 25 ° C. Αυτό σημαίνει ότι το προϊόν των συγκεντρώσεων των H₃o⁺ και Oh⁻ είναι πάντα σταθερό:
* Kw =[h₃o⁺] [oh⁻] =1.0 x 10⁻⁻⁴⁴
* ουδέτερο pH: Σε καθαρό νερό, οι συγκεντρώσεις των H₃o⁺ και Oh⁻ είναι ίσες, με αποτέλεσμα ένα pH του 7. Αυτό θεωρείται ουδέτερο.
* χαμηλότερες συγκεντρώσεις: Σε κάθε διάλυμα όπου η συγκέντρωση του H₃O⁺ είναι χαμηλότερη από εκείνη του καθαρού νερού, το διάλυμα θα έχει ρΗ υψηλότερο από 7 και θα θεωρηθεί βασικό ή αλκαλικό.
Επομένως, η χαμηλότερη συγκέντρωση ιόντων υδρονίου βρίσκεται σε καθαρό νερό, όπου η συγκέντρωση είναι 1,0 x 10 ⁻⁷ m.