Τι είναι η τιτλοδότηση;
Τιτλοδότηση είναι μια τεχνική προσδιορισμού της συγκέντρωσης ενός άγνωστου διαλύματος χρησιμοποιώντας ένα διάλυμα γνωστής συγκέντρωσης. Το γνωστό διάλυμα (τιτλοδότηση) προστίθεται σε σταγόνες στην αναλυόμενη ουσία (άγνωστο διάλυμα) μέχρι να επιτευχθεί το τελικό σημείο.
Είναι η λεμονάδα το αγαπημένο σας ρόφημα; Ή το προσθέτετε περιστασιακά στη διατροφή σας για απώλεια βάρους; Όποιος κι αν είναι ο λόγος, ξέρετε τι συγκέντρωση χυμού λεμονιού καταναλώνετε με τη μορφή λεμονάδας; Δεν ανησυχείτε μήπως προκαλέσετε βλάβη στο στομάχι σας εάν η συγκέντρωση υπερβεί το όριο;
Πρώτα από όλα… Χαλαρώστε! Δεν χρειάζεται να ανησυχείτε για τη συγκέντρωση του χυμού λεμονιού στη λεμονάδα σας.
Ωστόσο, όταν πρόκειται για ορισμένα φάρμακα, συντηρητικά τροφίμων, το επίπεδο pH της δεξαμενής ψαριών σας και σε διάφορες βιομηχανικές διαδικασίες, η συγκέντρωση διαφορετικών συστατικών στα διαλύματα παίζει σημαντικό ρόλο.
Εδώ μπαίνει στο παιχνίδι η τιτλοδότηση! Η τιτλοδότηση καθορίζει τη συγκέντρωση ενός διαλύματος ακολουθώντας ορισμένες αυστηρές διαδικασίες. Αυτό το άρθρο εξηγεί την αρχή και τη μεθοδολογία πίσω από την τιτλοδότηση.

Τιτλοδότηση σε δράση (Φωτογραφία :Torychemistry/Shutterstock)
Ποια είναι η αρχή της ογκομέτρησης;
Η τιτλοδότηση είναι μια ποσοτική ανάλυση για τον προσδιορισμό της συγκέντρωσης ενός άγνωστου διαλύματος με την προσθήκη ενός διαλύματος γνωστής συγκέντρωσης σε σταγόνα κάθε φορά. Με αυτή τη διαδικασία, το οξύ ή η βάση μιας γνωστής συγκέντρωσης εξουδετερώνει πλήρως το οξύ ή τη βάση της άγνωστης συγκέντρωσης. Η πραγματική αντίδραση που λαμβάνει χώρα κατά την εξουδετέρωση είναι μεταξύ ενός ιόντος υδρογόνου από οξύ και ιόντος υδροξειδίου από τη βάση που συνδυάζονται για να σχηματίσουν νερό. Είναι σημαντικό να διατηρείται ένα ομοιόμορφο pH σε όλη τη διάρκεια της διαδικασίας. Ως εκ τούτου, η αναλυόμενη ουσία και η τιτλοδότηση πρέπει να είναι ίσης συγκέντρωσης. Η συμμετοχή ισχυρού τιτλοδοτημένου και αραιωμένης αναλυόμενης ουσίας ή αντίστροφα θα επηρεάσει τη φυσική κατάσταση της αναλυόμενης ουσίας. Η διαδικασία παρακολουθείται γενικά από ηλεκτρόδια ή δείκτες pH.
Το διάλυμα γνωστής συγκέντρωσης είναι το τιτλοδοτημένο και το διάλυμα του οποίου η συγκέντρωση πρόκειται να προσδιοριστεί είναι η αναλυόμενη ουσία. Το σημείο ισοδυναμίας αυτής της διαδικασίας λαμβάνεται όταν ο τιτλοδοτητής εξουδετερώνει πλήρως τη βάση ή το οξύ στην αναλυόμενη ουσία.
Πώς πραγματοποιείται η τιτλοδότηση;
Η αναλυόμενη ουσία μετράται και γεμίζεται σε ένα ποτήρι ζέσεως. Λίγες σταγόνες δείκτη όξινης βάσης, όπως μεθυλοπορτοκάλι ή φαινολοφθαλεΐνη, προστίθενται στην αναλυόμενη ουσία.
Η φαινολοφθαλεΐνη παραμένει άχρωμη σε οξύ, αλλά γίνεται ροζ παρουσία μιας βάσης. Ομοίως, το πορτοκαλί μεθυλίου είναι μια κοκκινωπό-πορτοκαλί σκόνη που γίνεται βαθύ κόκκινο σε ένα οξύ και ωχροκίτρινο σε μια βάση.
Ένα πρότυπο διάλυμα λαμβάνεται σε προχοΐδα για να ξεκινήσει η διαδικασία. Το πρότυπο διάλυμα αφήνεται να στάξει αργά στο ποτήρι ζέσεως που περιέχει την αναλυόμενη ουσία. Η διαδικασία εκτελείται μέχρι να αλλάξει το χρώμα της αναλυόμενης ουσίας, υποδεικνύοντας την άφιξη ενός τελικού σημείου. Αυτό σημαίνει ότι όλη η βάση ή το οξύ στην αναλυόμενη ουσία έχει εξουδετερωθεί πλήρως από την τιτλοδότηση.
Σημειώνεται η μεταβολή όγκου του πρότυπου διαλύματος στο οποίο εμφανίζεται το τελικό σημείο. Αυτός ο όγκος υποδεικνύει την ποσότητα του τιτλοδοτήματος που έχει χρησιμοποιηθεί για την εξουδετέρωση της αναλυόμενης ουσίας. Αυτές οι τιμές χρησιμοποιούνται στη συνέχεια σε περαιτέρω υπολογισμούς.
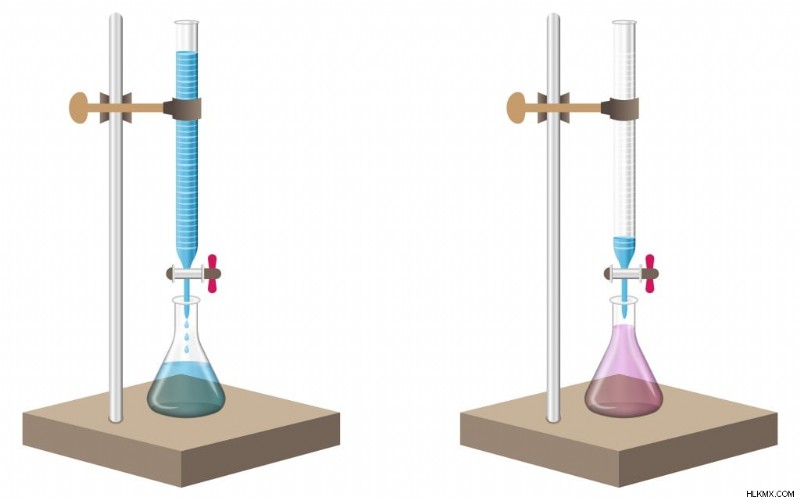
Αλλαγή χρώματος στην αναλυόμενη ουσία μετά την προσθήκη της τιτλοδότησης (Φωτογραφία :MeKa Design/Shutterstock)
Τίτλος τιτλοδότησης:Πώς υπολογίζεται η συγκέντρωση της αναλυόμενης ουσίας;
Όπως κάθε άλλη ποσοτική ανάλυση, η τιτλοδότηση έχει έναν τυπικό τύπο για τον προσδιορισμό της άγνωστης συγκέντρωσης. Ο γενικά χρησιμοποιούμενος τύπος είναι:
Όγκος τιτλοδότησης * γραμμομοριακή τιτλοδότηση =Όγκος αναλυόμενης ουσίας * μοριακότητα της αναλυόμενης ουσίας

Ας θεωρήσουμε ότι 45,6 ml υδροξειδίου του νατρίου 1,25 M έχουν χρησιμοποιηθεί για την εξουδετέρωση 20 ml υδροχλωρικού οξέος. Στη συνέχεια, η συγκέντρωση του HCl δίνεται από,
45,6 X 1,25 =20,0 * γραμμομοριακότητα της αναλυόμενης ουσίας.
Η επίλυση της παραπάνω εξίσωσης θα δώσει τη συγκέντρωση της αναλυόμενης ουσίας.
Τύποι τιτλοδότησης
Με βάση τον τύπο της αντίδρασης που εμπλέκεται, η τιτλοδότηση ταξινομείται σε 4 διαφορετικούς τύπους.
- Τιτλοδότηση οξέος-βάσης: Αυτό βασίζεται στην εξουδετέρωση μεταξύ ενός οξέος ή μιας βάσης και της αναλυόμενης ουσίας.
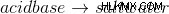
- Συμπλοκομετρική ογκομέτρηση: Αυτό χρησιμοποιείται ευρέως για τον προσδιορισμό του αριθμού των μεταλλικών ιόντων που εμπλέκονται στην αντίδραση. Το EDTA χρησιμοποιείται ως δείκτης. Στο τέλος αυτής της ογκομέτρησης, σχηματίζεται ένα αδιάσπαστο σύμπλοκο που σηματοδοτεί το σημείο ισοδυναμίας. Για παράδειγμα:
Ag+ + 2CN– → [Ag(CN)2]–
- Τιτλοποίηση οξειδοαναγωγής: Σε αυτόν τον τύπο, η μεταφορά ηλεκτρονίων γίνεται στα αντιδρώντα ιόντα του διαλύματος. Περαιτέρω ταξινομείται σε 3 τύπους με βάση τον τύπο του αντιδραστηρίου που χρησιμοποιείται.
Υπερμαγγανικό:MnO4–+ 8H + 5e → Mn2++ 4H2
Διχρωμικό:K2Cr2O7+ 4H2SO4 → K2Cr2(SO4) + 4H2O + 3[O]
Ιωδιομετρική και ιωδομετρική:l2 + 2e → 2l–
- Τιτλοδότηση υετού: Αυτή η αντίδραση σχηματίζει ένα αδιάλυτο ίζημα όταν οι δύο αντιδρώντες ουσίες έρχονται σε επαφή.
AgNO3 + NaCl → AgCl + NaNO3
Βοηθητικό πρόγραμμα τιτλοδότησης:Πρακτικές εφαρμογές και παραδείγματα
Η τιτλοδότηση πιθανώς εφαρμόζεται με τον ένα ή τον άλλο τρόπο στις καθημερινές μας δραστηριότητες. Διάφορες κλινικές δοκιμές, όπως εξετάσεις αίματος και ούρων, χρησιμοποιούν τιτλοδότηση για τον προσδιορισμό της συγκέντρωσης των χημικών ουσιών που ενδιαφέρουν. Χρησιμοποιείται επίσης στη βιομηχανία τροφίμων για τον προσδιορισμό της ποσότητας ορισμένων χημικών ουσιών στα τρόφιμα.
Συχνά, χρησιμοποιείται για τον προσδιορισμό της περιεκτικότητας σε υδατάνθρακες, λίπος και βιταμίνες. Η τιτλοδότηση εφαρμόζεται επίσης ευρέως στον ιατρικό τομέα. Οι δοκιμές εγκυμοσύνης, οι δοκιμές επιπέδων γλυκόζης στο αίμα και άλλες εφαρμογές ανάλυσης ούρων χρησιμοποιούν τιτλοδότηση. Περιλαμβάνεται επίσης ως μέρος των ακαδημαϊκών για μαθητές γυμνασίου για να αναλύσουν τις πρακτικές τους ικανότητες.
Οι ιδιότητες του θαλασσινού νερού, όπως η συγκέντρωση αμμωνίας, τα νιτρικά άλατα και το επίπεδο pH υπολογίζονται και το περιβάλλον τροποποιείται ανάλογα για να διατηρηθούν οι βέλτιστες συνθήκες.
Η συγκέντρωση - που συνήθως εκφράζεται ως μοριακότητα (αριθμός γραμμομορίων διαλυμένης ουσίας ανά λίτρο σε διάλυμα) - έχει μεγάλη σημασία στη χημεία επειδή καθορίζει τους ρυθμούς αντίδρασης και τις συνθήκες ισορροπίας. Η τιτλοδότηση είναι η πιο εμφανής και ευρέως χρησιμοποιούμενη μέθοδος για τον προσδιορισμό άγνωστης συγκέντρωσης.