Μονομερές Πρωτεΐνης
Οι πρωτεΐνες είναι οργανικά μακρομόρια που εκτελούν πολλές λειτουργίες στο σώμα. Τα μονομερή (μεμονωμένες μονάδες) των πρωτεϊνών ονομάζονται αμινοξέα . Τα περισσότερα αμινοξέα αποτελούνται από υδρογόνο (Η), άνθρακα (C), οξυγόνο (Ο) και άζωτο (Ν). Εκτός από το νερό, τα αμινοξέα (με τη μορφή πρωτεϊνών) αποτελούν το μεγαλύτερο μέρος του ανθρώπινου ιστού. Υπάρχουν πάνω από 500 γνωστά αμινοξέα στο ανθρώπινο σώμα τα οποία ταξινομούνται σε σχέση με την πολικότητα, το σχήμα και τις συνδεδεμένες λειτουργικές ομάδες. Στο ανθρώπινο σώμα, τα αμινοξέα με ομάδες αμίνης και καρβοξυλίου έχουν ιδιαίτερη σημασία. Οι πρωτεΐνες εκτελούν μια εκπληκτική σειρά λειτουργιών στο ανθρώπινο σώμα, επομένως τα αμινοξέα που τις αποτελούν είναι απαραίτητα για τη ζωή όπως τη γνωρίζουμε.
Η συσσωμάτωση αμινοξέων σε μια μοναδική πρωτεΐνη είναι το τελικό προϊόν της γονιδιακής έκφρασης. Οι οδηγίες για τη δημιουργία της πρωτεΐνης κωδικοποιούνται στην αλληλουχία των βάσεων νουκλεοτιδίων που περιέχονται σε ένα μόνο τμήμα του DNA. Το RNA μεταγράφει αυτές τις οδηγίες που κωδικοποιούνται στο DNA με τη μορφή mRNA. Οι κλώνοι του mRNA περιέχουν κωδικόνια, τμήματα 3 βάσεων, όπου κάθε ομάδα τριών βάσεων αντιστοιχεί με ένα συγκεκριμένο αμινοξύ. Το tRNA συνδέεται με τα αντίστοιχα τμήματα βάσης, μεταφέροντας μαζί του το καθορισμένο αμινοξύ. Τα αμινοξέα συνδέονται μεταξύ τους για να σχηματίσουν μια πολυπεπτιδική βάση. Αρκετοί πολυπεπτιδικοί κλώνοι συνδέονται μεταξύ τους για να δημιουργήσουν μια πλήρη πρωτεΐνη.
Εκτός από το ότι είναι οι βασικές μονάδες των πρωτεϊνών, τα αμινοξέα από μόνα τους παίζουν σημαντικό βιολογικό ρόλο. Αμινοξέα όπως το γλουταμινικό και το γ-αμινοβουτυρικό οξύ (GABA) ρυθμίζουν την πυροδότηση των νευρώνων στον εγκέφαλο, ενώ άλλα όπως η προλίνη και η γλυκίνη αποτελούν συστατικά βιολογικών δομών και υποδομών.
Αμινοξέα:Τα βασικά
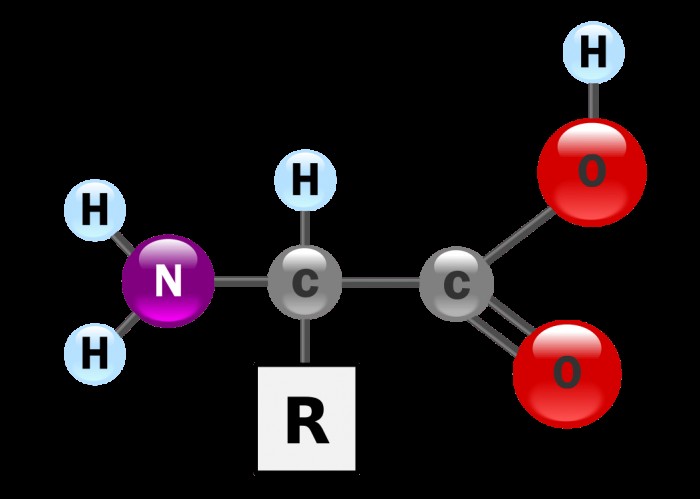
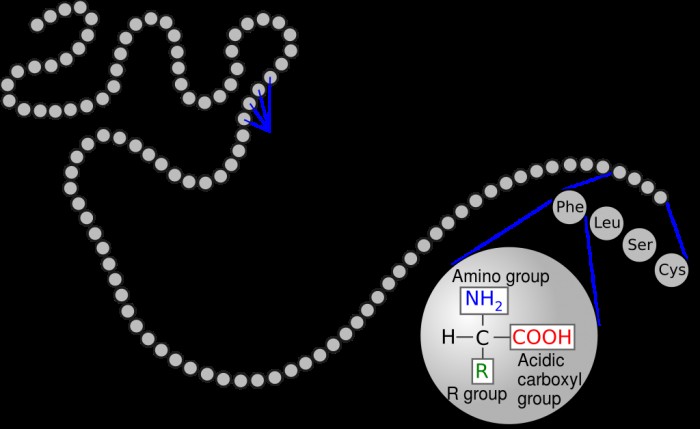
Τα αμινοξέα έχουν μια κοινή δομή που αποτελείται από ένα κεντρικό άτομο άνθρακα συνδεδεμένο με μια αμινομάδα (NH2 ) και μια καρβοξυλική ομάδα (COOH). In vivo, τα αμινοξέα υπάρχουν συνήθως σε ένα όξινο διάλυμα, όπου έχουν αποπρωτονιωθεί, κάθε ομάδα χάνει υδρογόνο και έτσι έχει θετικό φορτίο.
Το "R" σημαίνει μια συνδεδεμένη πλευρική αλυσίδα, η οποία είναι το τμήμα που είναι μοναδικό για κάθε είδος αμινοξέος. Η συγκεκριμένη αλυσίδα R καθορίζει την ταυτότητα του αμινοξέος. Εάν η ομάδα R είναι υδρογόνο, τότε είναι γλυκίνη. αν είναι δακτύλιος βενζολίου τότε είναι φαινυλαλανίνη. Οι ιδιότητες της πλευρικής αλυσίδας καθορίζουν πολλές από τις φυσικές ιδιότητες ολόκληρου του αμινοξέος, όπως η διαλυτότητα, η οξύτητα, η πολικότητα και αν είναι οξειδωτικό ή αναγωγικό.
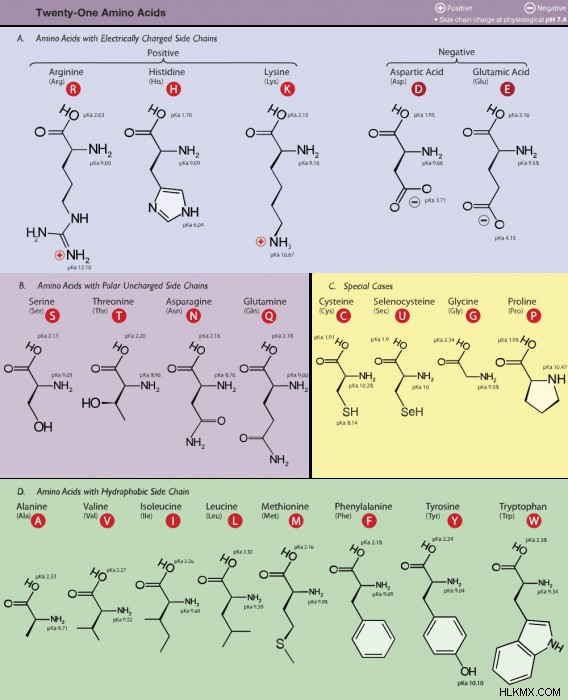
Παρόλο που υπάρχουν πάνω από 500 γνωστά αμινοξέα, το ανθρώπινο DNA κωδικοποιεί μόνο περίπου 20. Αυτά τα 20 αμινοξέα είναι εκείνα που στην πραγματικότητα παράγουν πρωτεΐνες. Διάφορα άλλα αμινοξέα συντίθενται και έχουν χρήσεις εκτός της παραγωγής πρωτεϊνών.
Από αυτά τα 20 αμινοξέα, το ανθρώπινο σώμα δεν είναι σε θέση να συνθέσει 9 χρησιμοποιώντας υπάρχουσες ενώσεις στο σώμα. Αυτά τα 9 «απαραίτητα» αμινοξέα πρέπει να καταναλώνονται από εξωτερικές πηγές. Τα 9 απαραίτητα αμινοξέα είναι η φαινυλαλανίνη, βαλίνη, θρεονίνη, τρυπτοφάνη, μεθειονίνη, λευκίνη, ισολευκίνη, λυσίνη και ιστιδίνη
Πώς τα αμινοξέα παράγουν πρωτεΐνες;
Οι πρωτεΐνες είναι αλυσίδες πολυπεπτιδίων, συστάδες φτιαγμένες από συνδεδεμένα αμινοξέα. Τα αμινοξέα συνδέονται με γειτονικά αμινοξέα μέσω ομοιοπολικών δεσμών που ονομάζονται πεπτιδικοί δεσμοί. Οι πεπτιδικοί δεσμοί εμφανίζονται όταν η καρβοξυλομάδα ενός αμινοξέος συνδέεται με την αμινομάδα ενός άλλου. Η αντίδραση αφαιρεί ένα μόνο μόριο νερού και οδηγεί σε έναν ομοιοπολικό δεσμό μεταξύ άνθρακα και αζώτου.
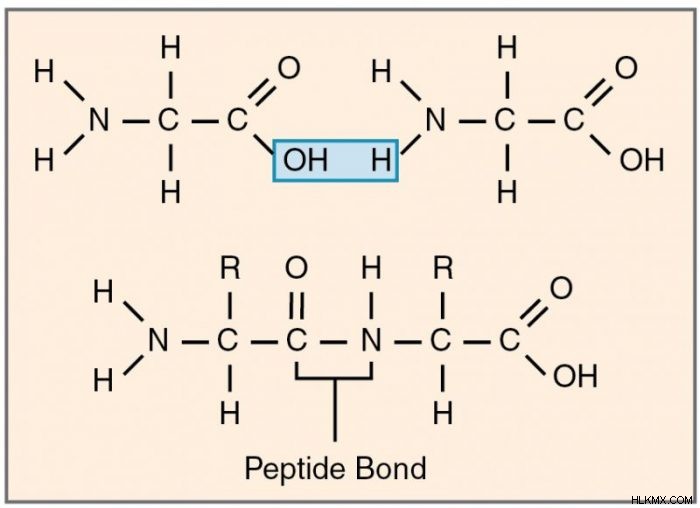
Δεδομένου ότι τα αμινοξέα είναι γεωμετρικά ασύμμετρα, οι πολυπεπτιδικές αλυσίδες έχουν κατεύθυνση. Το ένα άκρο καταλήγει σε μια αμινομάδα βάσης αζώτου, ενώ το άλλο καταλήγει σε μια καρβοξυλική ομάδα με βάση τον άνθρακα.
Τα αμινοξέα συναρμολογούνται φυσικά σε πολυπεπτιδικούς κλώνους κατά τη διάρκεια της διαδικασίας μετάφρασης RNA. Κατά τη μετάφραση, ένα μεταγραφόμενο mRNA συνδέεται με ένα ριβόσωμα. Άλλα μόρια RNA, που ονομάζονται tRNA, συνδέονται με το mRNA μέσω συμπληρωματικού ζεύγους βάσεων νουκλεοτιδίων. Τα μόρια του tRNA φέρουν τα αμινοξέα που καθορίζονται από τα κωδικόνια mRNA. Για παράδειγμα, εάν το κωδικόνιο mRNA είναι «AUG», τότε το αντίστοιχο ζεύγος βάσεων tRNA είναι «TAC», το οποίο προσδιορίζει το αμινοξύ μεθειονίνη. Ομοίως, το κωδικόνιο UGG κωδικοποιεί για το αμινοξύ τρυπτοφάνη. Το tRNA συνδέεται με το mRNA τοποθετώντας τα αμινοξέα το ένα δίπλα στο άλλο, τα οποία στη συνέχεια σχηματίζουν πεπτιδικούς δεσμούς και δημιουργούν μια πολυπεπτιδική αλυσίδα
Γενικά, μετά την κατασκευή, η πολυπεπτιδική αλυσίδα υφίσταται μερικές τροποποιήσεις μετά τη μετάφραση, όπου μπορούν να προστεθούν ομάδες ή ορισμένες αλληλουχίες τροποποιούνται ελαφρώς σε άλλες αλληλουχίες.
Δομή Πρωτεϊνών
Κάθε πρωτεΐνη προσδιορίζεται μοναδικά από την αλληλουχία αμινοξέων που περιέχει. Η σειρά αυτών των αμινοξέων επηρεάζει τη λειτουργία της πρωτεΐνης. Αλλαγές στο DNA μπορεί να προκύψουν είναι μια αλλαγή στην εκφρασμένη αλληλουχία αμινοξέων, η οποία θα επηρεάσει τη λειτουργία της σχετικής πρωτεΐνης. Για παράδειγμα, τα συμπτώματα που σχετίζονται με τη δρεπανοκυτταρική αναιμία οφείλονται σε μία διαφορά στην αλληλουχία αμινοξέων που καθορίζει την αιμοσφαιρίνη. Το γλουταμινικό οξύ που καταλαμβάνει την 6η θέση αντικαθίσταται από βαλίνη. Το αποτέλεσμα είναι ότι οι δημιουργούμενες πρωτεΐνες αιμοσφαιρίνης έχουν ένα μακρύ σχήμα σαν νήμα. Αυτό το σχήμα σαν νήμα αλλάζει το σχήμα των αιμοσφαιρίων, με αποτέλεσμα να κολλάνε στα κυτταρικά τοιχώματα και να βλάπτουν τη ροή του αίματος.
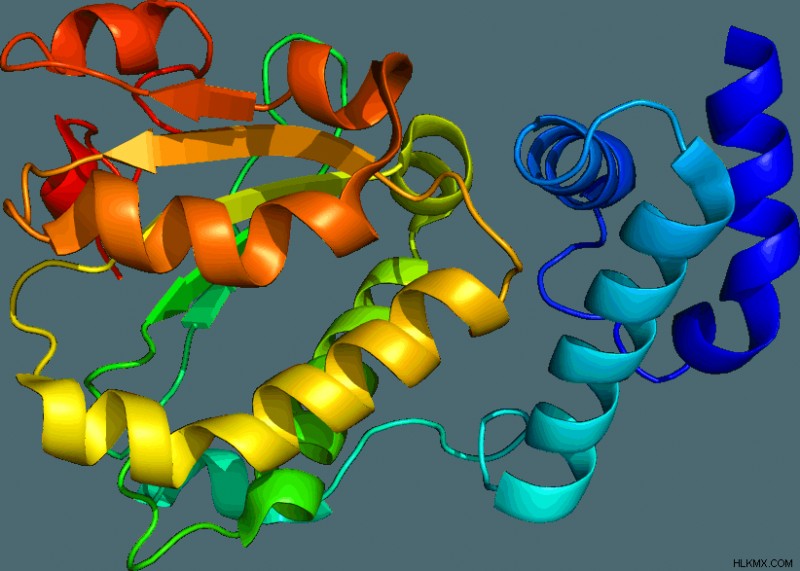
Εκτός από την αλληλουχία αμινοξέων, που ονομάζεται πρωτογενής δομή , οι πρωτεΐνες έχουν μια δευτερεύουσα δομή που αναφέρεται στη γεωμετρική αναδίπλωση της ραχοκοκαλιάς της πεπτιδικής αλυσίδας. Υπάρχουν δύο κύρια είδη δευτερογενών δομών που παρατηρούνται στο ανθρώπινο σώμα, που ονομάζονται α-έλικα και β-πτυχωτό φύλλο.
Σε μια δομή α-έλικας, η πεπτιδική αλυσίδα περιστρέφεται γύρω από τον εαυτό της σαν ένα κουλουριασμένο φίδι. Η ομάδα καρβονυλίου σε ένα αμινοξύ συνδέεται με υδρογόνο με τις κηλίδες της ομάδας αμίνης 4 προς τα κάτω. Η δομή που προκύπτει είναι μια σφιχτά περιελιγμένη έλικα που συγκρατείται μεταξύ τους με δεσμούς υδρογόνου. Τα β-πτυχωμένα φύλλα, από την άλλη πλευρά, αποτελούνται από γραμμικές αλυσίδες πολυπεπτιδίων στοιβαγμένες πλευρικά, συγκρατημένες μεταξύ τους με δεσμούς υδρογόνου μεταξύ των ομάδων αμίνης και καρβονυλίου γειτονικών αμινοξέων. Ορισμένα αμινοξέα είναι πιο πιθανό να σχηματίσουν δομές α-έλικας από ό,τι τα φύλλα με β πτυχώσεις και αντίστροφα.
Τέλος, οι πρωτεΐνες έχουν μια συνολική τρισδιάστατη δομή που ονομάζεται τριτογενής δομή. Η τριτογενής δομή είναι η τρισδιάστατη γεωμετρία ολόκληρης της πρωτεΐνης και καθορίζεται από την αλληλεπίδραση των πλευρικών αλυσίδων R. Οι αλυσίδες R αλληλεπιδρούν μέσω σχεδόν κάθε γνωστού μη ομοιοπολικού δεσμού. Το εάν οι ομάδες R είναι υδρόφοβες ή υδρόφιλες επηρεάζει τον προσανατολισμό της πρωτεΐνης.
Πολλές πρωτεΐνες αποτελούνται από μία μόνο πολυπεπτιδική αλυσίδα, αλλά μερικές αποτελούνται από πολλαπλές πολυπεπτιδικές αλυσίδες συσσωματωμένες μεταξύ τους. Αυτά τα είδη πρωτεϊνών πολυπεπτιδικής αλυσίδας έχουν τεταρτοταγή δομή, αυτή που καθορίζεται από τις αλληλεπιδράσεις των αντίστοιχων τριτογενών δομών. Η αιμοσφαιρίνη είναι μια τέτοια πρωτεΐνη που αποτελείται από 4 πολυπεπτιδικές αλυσίδες 2 καθεμία από τις δομές α και β.
Οι πρωτεΐνες απαιτούν ορισμένες τιμές pH και θερμοκρασίες για να διατηρήσουν το σχήμα τους. Όταν οι θερμοκρασίες των τιμών του pH γίνουν πολύ υψηλές ή χαμηλές, οι διαμοριακές αλληλεπιδράσεις που συγκρατούν την πρωτεΐνη μαζί μπορεί να διαταραχθούν και η πρωτεΐνη θα ξετυλιχτεί, χάνοντας το σχήμα της. Οι μη διαλυμένες πρωτεΐνες ονομάζονται «μετουσιωμένες» πρωτεΐνες και δεν μπορούν πλέον να εκτελέσουν τις λειτουργίες τους. Για παράδειγμα, οι πολύ ψηλοί πυρετοί είναι επικίνδυνοι επειδή η θερμότητα μπορεί να μετουσιώσει τις πρωτεΐνες στον εγκέφαλο, ξετυλίγοντας και εμποδίζοντάς τις να λειτουργήσουν.
Άλλες χρήσεις αμινοξέων
Άλλα αμινοξέα που δεν κατασκευάζουν πρωτεΐνες παίζουν σημαντικούς βιολογικούς ρόλους. Ένα εντυπωσιακό παράδειγμα είναι το γάμμα-αμινοβουτυρικό οξύ (GABA). Το GABA είναι ένα αμινοξύ που είναι ζωτικής σημασίας για τη νευρολογική λειτουργία. Το GABA στον εγκέφαλο είναι ο κύριος νευροδιαβιβαστής που ρυθμίζει την ενεργοποίηση των δυναμικών δράσης στους νευρώνες του εγκεφάλου. Συγκεκριμένα, η αναστολή με τη μεσολάβηση GABA είναι μια διαδικασία αρνητικής ανάδρασης στον εγκέφαλο που μειώνει τους νευρώνες, εμποδίζοντάς τους να πυροδοτηθούν. Το GABA συνδέεται με τη δομή στους άξονες, ρυθμίζοντας τη ροή των ιόντων καλίου και νατρίου, τα οποία ρυθμίζουν την πυροδότηση των δυναμικών δράσης. Το GABA είναι επίσης υπεύθυνο για τη ρύθμιση του μυϊκού τόνου στα θηλαστικά.
Τα αμινοξέα χρησιμεύουν επίσης ως πρόδρομοι σε άλλα σημαντικά βιολογικά μόρια, όπως η σεροτονίνη, η ντοπαμίνη, η επινεφρίνη και τα νουκλεοτίδια.
Συνοψίζοντας, τα αμινοξέα είναι τα μονομερή των πρωτεϊνών. Τα αμινοξέα αποτελούνται από ένα κεντρικό άτομο άνθρακα συνδεδεμένο με μια ομάδα αμίνης και καρβοξυλίου, συνδεδεμένο με μια πλευρική αλυσίδα. Η φύση της συνδεδεμένης πλευρικής αλυσίδας καθορίζει την ειδική ταυτότητα του αμινοξέος και τη δεσμευτική του συμπεριφορά.
Κατά τη διαδικασία της μετάφρασης RNA, αλληλουχίες αμινοξέων ενώνονται με βάση τις πληροφορίες που κωδικοποιούνται στο σχετικό τμήμα του DNA. Τα αμινοξέα σχηματίζουν έναν ομοιοπολικό δεσμό μεταξύ της αμίνης τους και μιας καρβοξυλικής ομάδας, σχηματίζοντας μακριές αλυσίδες που ονομάζονται πολυπεπτιδικοί κλώνοι. Οι πολυπεπτιδικοί κλώνοι θα διπλωθούν στη συνέχεια στην κατάλληλη δομή, σχηματίζοντας μια πλήρως αναπτυγμένη πρωτεΐνη. Σε ορισμένες περιπτώσεις, πολλαπλοί πολυπεπτιδικοί κλώνοι συνδέονται μεταξύ τους για να δημιουργήσουν πρωτεΐνες που είναι σύμπλεγμα πολλαπλών πολυπεπτιδικών κλώνων. Η ακριβής ταυτότητα της πρωτεΐνης και η σχετιζόμενη λειτουργία της καθορίζεται από την ακριβή αλληλουχία αμινοξέων της. Μια αλλαγή σε αυτή την αλληλουχία μπορεί να επιφέρει μια αλλαγή στη λειτουργία της πρωτεΐνης. Οι πρωτεΐνες που χάνουν το σχήμα τους μετουσιώνονται και κανονικά δεν είναι πλέον λειτουργικές.




