Τι είναι ένας μη πολικός ομοιοπολικός δεσμός;
Μη πολικοί ομοιοπολικοί δεσμοί είναι δεσμοί όπου και τα δύο άτομα έχουν την ίδια ηλεκτραρνητικότητα, και επομένως τα ηλεκτρόνια στον δεσμό ηλεκτρονίων μοιράζονται εξίσου μεταξύ τους. Σημειώστε ότι αυτό πρέπει να συμβεί μεταξύ δύο ατόμων μη μετάλλου προκειμένου να είναι ένας σωστός μη πολικός ομοιοπολικός δεσμός.
Αυτός είναι ένας γρήγορος ορισμός των μη πολικών ομοιοπολικών δεσμών, αλλά μια πιο προσεκτική εξέταση του τι σημαίνει ένας δεσμός να είναι ομοιοπολικός και τι σημαίνει μια ουσία να είναι μη πολικός, θα σας βοηθήσει να κατανοήσετε τους μη πολικούς ομοιοπολικούς δεσμούς με μεγαλύτερη λεπτομέρεια.
Τι είναι ο ομοιοπολικός δεσμός;
Στη χημεία, ένας ομοιοπολικός δεσμός είναι μια χημική δομή που ενώνει δύο ιόντα ή άτομα, που αποτελούνται από τα ηλεκτρόνια που μοιράζονται μεταξύ αυτών των ατόμων. Οι ομοιοπολικοί δεσμοί αναφέρονται επίσης μερικές φορές ως μοριακοί δεσμοί. Οι ομοιοπολικοί δεσμοί συμβαίνουν συνήθως μεταξύ δύο ατόμων που είναι αρκετά κοντά σε ηλεκτραρνητικότητα και τα οποία είναι στη φύση τους μη μέταλλα. Τούτου λεχθέντος, άλλα χημικά είδη μπορούν επίσης να σχηματίσουν ομοιοπολικούς δεσμούς όπως μακρομόρια και ρίζες. Τα ζεύγη ηλεκτρονίων που δημιουργούν έναν ομοιοπολικό δεσμό ονομάζονται συχνά κοινά ζεύγη, μερικές φορές ονομάζονται ζεύγη δεσμών. Το αποτέλεσμα των κοινών ζευγών είναι ότι και τα δύο άτομα που εμπλέκονται στον δεσμό έχουν συνήθως ένα σταθερό εξωτερικό κέλυφος ηλεκτρονίων, σταθερότητα παρόμοια με αυτή που παρατηρείται στα άτομα των στοιχείων ευγενούς αερίου.
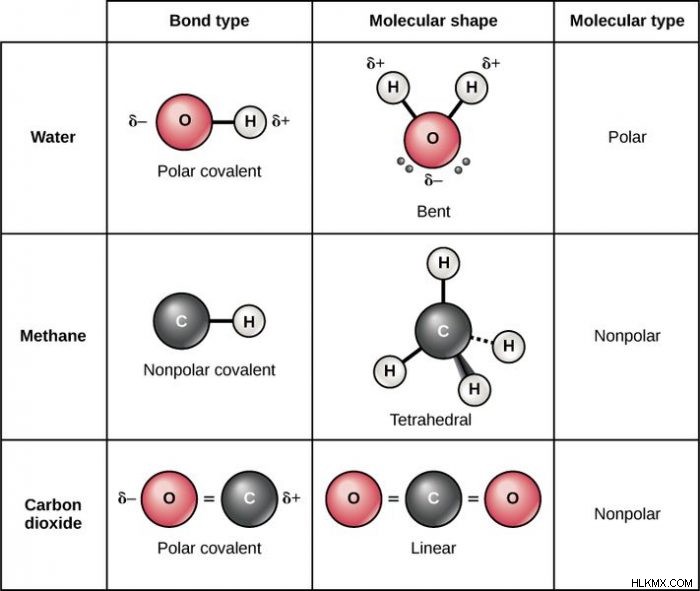
Μια χημική ένωση που περιέχει άτομα που σχηματίζουν ομοιοπολικούς δεσμούς αναφέρεται ως ομοιοπολική ένωση. Οι ομοιοπολικές ενώσεις είναι μία από τις δύο κατηγορίες στις οποίες συνήθως ομαδοποιούνται οι ενώσεις. Το άλλο είδος ένωσης είναι μια ιοντική ένωση και οι ιοντικές ενώσεις αποτελούνται από ηλεκτρικά φορτισμένα μόρια ή άτομα, χάρη σε μια ηλεκτρική ανισορροπία που προκαλείται από την απώλεια ή την απόκτηση ηλεκτρονίων. Αυτό συμβαίνει συνήθως ως αποτέλεσμα μεταλλικών στοιχείων που αλληλεπιδρούν με ένα μη μεταλλικό στοιχείο. Παραδείγματα ομοιοπολικών ενώσεων περιλαμβάνουν DNA, νερό και σακχαρόζη.
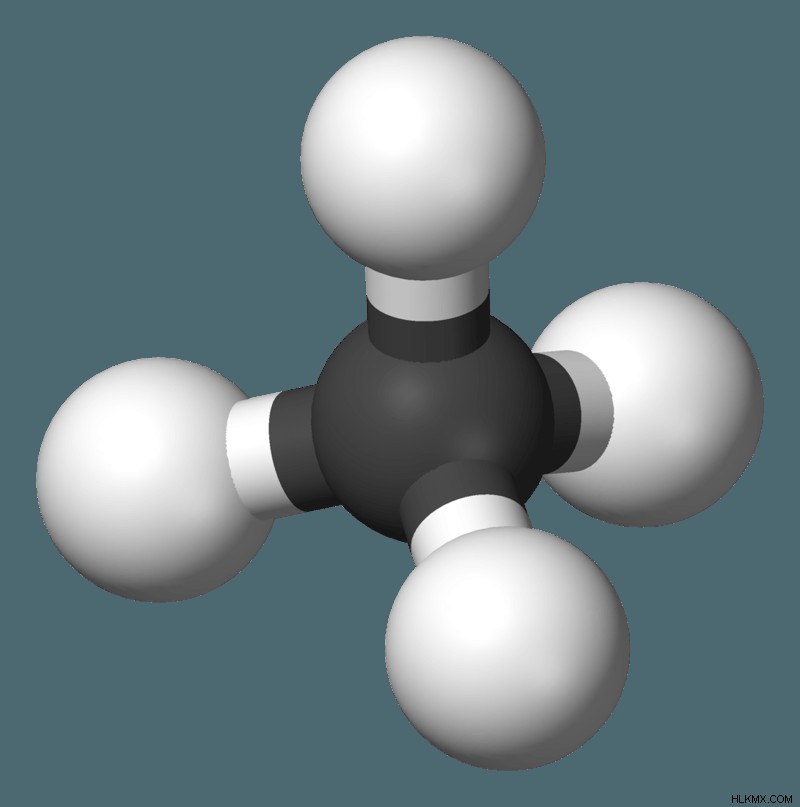
Οι δύο πιο αξιοσημείωτοι τύποι ομοιοπολικών δεσμών είναι οι πολικοί ομοιοπολικοί δεσμοί και οι καθαροί/μη πολικοί ομοιοπολικοί δεσμοί. Αυτό που διακρίνει τους μη πολικούς ομοιοπολικούς δεσμούς είναι ότι τα ηλεκτρόνια τους μοιράζονται εξίσου. Τα ίδια άτομα, τα άτομα που έχουν τις ίδιες τιμές ηλεκτραρνητικότητας έχουν ίσο μερίδιο ηλεκτρονίων, αλλά ο ορισμός περιστασιακά επεκτείνεται για να καλύψει τυχόν άτομα που έχουν περίπου ίση κατανομή ηλεκτρονίων, άτομα με διαφορές ηλεκτραρνητικότητας μικρότερες από 0,4. Τα μόρια που έχουν τέτοιους μη πολικούς δεσμούς περιλαμβάνουν τα CH4, N2 και H2.
Η ηλεκτραρνητικότητα των δύο ατόμων επηρεάζει τον τρόπο με τον οποίο τα ηλεκτρόνια που σχηματίζουν έναν δεσμό μοιράζονται μεταξύ των ατόμων. Καθώς η διαφορά στην ηλεκτραρνητικότητα μεγαλώνει, ο δεσμός μεταξύ των ζευγών ηλεκτρονίων συνδέεται περισσότερο με το ένα άτομο παρά με το άλλο άτομο. Υπάρχουν διάφορα κατώφλια που διακρίνουν τα χαρακτηριστικά ενός δεσμού. Οι δεσμοί που έχουν διαφορές ηλεκτραρνητικότητας από 0 έως 0,3 θεωρούνται μη πολικοί δεσμοί, ενώ όσοι έχουν διαφορές που κυμαίνονται από 0,4 έως 1,7 ταξινομούνται ως πολικοί δεσμοί. Τέλος, ιοντικοί δεσμοί είναι εκείνοι όπου η διαφορά ηλεκτραρνητικότητας είναι πάνω από 1,7.
Ας δούμε μερικά παραδείγματα ομοιοπολικών δεσμών. Ομοιοπολικοί δεσμοί βρίσκονται σε μόρια νερού, τα οποία έχουν τον χημικό τύπο H2O. Κάθε άτομο υδρογόνου στο μόριο μοιράζεται έναν ομοιοπολικό δεσμό με το οξυγόνο. Υπάρχουν δύο ηλεκτρόνια σε καθέναν από τους ομοιοπολικούς δεσμούς, ένα που προέρχεται από το άτομο υδρογόνου και ένα προέρχεται από το άτομο οξυγόνου. Δεδομένου ότι η ηλεκτραρνητικότητα των δύο ατόμων είναι σχετικά παρόμοια, τα ηλεκτρόνια μοιράζονται μεταξύ των δύο ατόμων λίγο πολύ εξίσου.
Το μόριο υδρογόνου στο H2O αποτελείται από δύο άτομα υδρογόνου που συνδέονται με έναν ομοιοπολικό δεσμό. Το άτομο υδρογόνου διατηρεί ένα σταθερό εξωτερικό κέλυφος ηλεκτρονίων έχοντας δύο ηλεκτρόνια σε αυτό το κέλυφος και το θετικό φορτίο των ατομικών πυρήνων του υδρογόνου προσελκύει ηλεκτρόνια σε αυτό, γεγονός που κρατά τα μόρια μεμονωμένα συστατικά συγκρατημένα μαζί. Ο φώσφορος είναι ικανός να σχηματίσει δύο διαφορετικά μόρια όταν συνδυάζεται με χλώριο. Ο φώσφορος και το χλώριο μπορούν να δημιουργήσουν είτε PCl3 είτε PCl5.
Και τα δύο αυτά μόρια έχουν ομοιοπολικούς δεσμούς που ενώνουν τα άτομα φωσφόρου και χλωρίου μεταξύ τους, και στην περίπτωση του PCl3 το μόριο παίρνει τις παραδοσιακές δομές ευγενών αερίων, όπου το εξωτερικό κέλυφος ηλεκτρονίων είναι εντελώς γεμάτο. Ενώ το PCl3 είναι ένα σταθερό μόριο, το PCl5 τυχαίνει επίσης να είναι ένα σταθερό μόριο, οπότε ενώ ο κανόνας της οκτάδας είναι ένα εύχρηστο ευρετικό για τον προσδιορισμό της σταθερότητας ενός μορίου, θα πρέπει να θυμόμαστε ότι οι ομοιοπολικοί δεσμοί δεν ακολουθούν πάντα αυτόν τον κανόνα.
Τι είναι η πολικότητα;
Στην καθημερινή σας ζωή, είναι πολύ πιθανό να ακούσετε τον όρο «πολικό» σε σχέση με τους πόλους στα άκρα της γης, τον Βόρειο και τον Νότιο πόλο. Η θέση αυτών των πόλων βρίσκεται σε αντίθετα σημεία στην επιφάνεια του πλανήτη. Όπως και οι πόλους που βρίσκονται στο ακραίο βόρειο και νότιο τμήμα της Γης, μια μπαταρία έχει επίσης πόλους, ένα αρνητικό άκρο και ένα θετικό άκρο. Στο πλαίσιο των μπαταριών, το ένα άκρο της μπαταρίας έχει θετικό φορτίο ενώ το αντίθετο έχει αρνητικό φορτίο. Όπως και οι μπαταρίες, τα άτομα μπορούν να έχουν πόλους και πολικότητα, ακόμη και οι δεσμοί που βρίσκονται μεταξύ των ατόμων μπορεί να έχουν πολικότητα. Τα μόρια ταξινομούνται ως πολικά όταν τα άτομα που αποτελούν το μόριο είναι διατεταγμένα με τρόπο που το ένα άκρο του μορίου έχει καθαρό αρνητικό φορτίο ενώ το αντίθετο έχει καθαρό θετικό φορτίο.
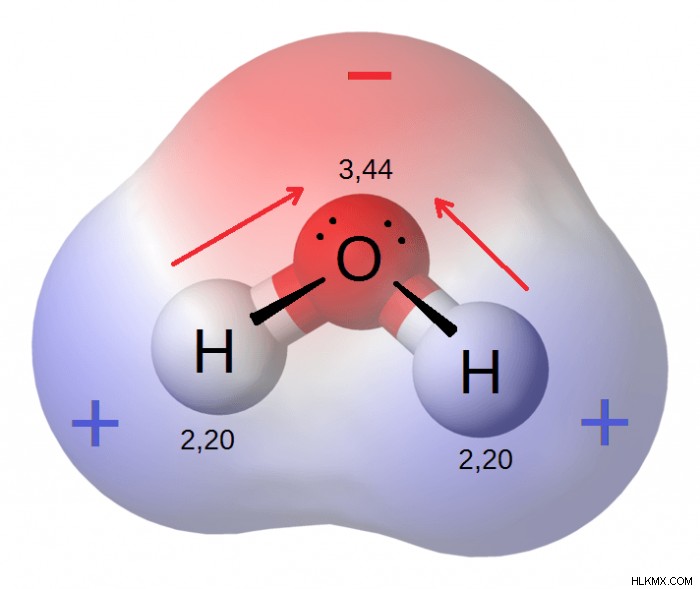
Τα άτομα που έχουν ασθενή ηλεκτραρνητικότητα μπορούν να συνδεθούν με αυτά που έχουν υψηλότερη τιμή ηλεκτραρνητικότητας και όταν συμβαίνει αυτό δημιουργείται ένα πολικό μόριο. Οι ηλεκτρικοί πόλοι δημιουργούνται όταν ενώνονται άτομα με διαφορετικά επίπεδα ηλεκτραρνητικότητας και η πολική φύση των μορίων που δημιουργούνται με αυτόν τον τρόπο σημαίνει ότι μπορούν να συνδεθούν με πολλά άλλα είδη μορίων. Το γεγονός ότι τα πολικά μόρια έχουν τόσο αρνητική όσο και θετική περιοχή τους επιτρέπει να συνδέονται με μια μεγάλη ποικιλία άλλων χημικών δομών. Το νερό είναι ένα πολικό μόριο και χάρη στην πολική φύση του είναι σε θέση να ενώσει πολλά άλλα μόρια και να χρησιμεύσει ως βάση για τη ζωή στη Γη.
Εάν τα πολικά μόρια έχουν ηλεκτρικούς πόλους, ίσως μπορείτε να μαντέψετε ότι τα μη πολικά μόρια δεν έχουν ηλεκτρικούς πόλους. Τα μη πολικά μόρια στερούνται ένα αξιοσημείωτο φορτίο και στα δύο μισά της δομής, έχοντας μια περισσότερο ή λιγότερο ομοιόμορφη κατανομή ηλεκτρονίων σε ολόκληρο το μόριο. Έτσι, για να συνοψίσουμε, τα μη πολικά μόρια δεν έχουν διαφορές στα φορτία και στα δύο άκρα του μορίου, με τα φορτία των ατόμων να ακυρώνουν το ένα το άλλο. Εν τω μεταξύ, τα πολικά μόρια είναι αξιοσημείωτα για το γεγονός ότι τα δίπολά τους έχουν και καθαρό αρνητικό και καθαρό θετικό φορτίο.
Παραδείγματα πολικών και μη πολικών μορίων
Ας δούμε μερικά συγκεκριμένα παραδείγματα πολικών και μη πολικών μορίων.
Όπως αναφέρθηκε, το νερό είναι ένα πολικό μόριο και οι δεσμοί που ενώνουν τα άτομα οξυγόνου και υδρογόνου είναι κατανεμημένοι έτσι ώστε να υπάρχει ίσος χώρος και στα δύο μισά του δεσμού οξυγόνου-υδρογόνου και αυτή η διάταξη σημαίνει ότι το μισό του μορίου έχει καθαρό αρνητικό φορτίο ενώ το άλλο μισό διατηρεί θετικό φορτίο. Ένα άλλο πολικό μόριο είναι η αιθανόλη, η οποία αποκτά την πολική της φύση λόγω του γεγονότος ότι τα άτομα οξυγόνου που βρίσκονται μέσα στο μόριο έχουν μεγαλύτερη ηλεκτραρνητικότητα από τα άτομα που την περιβάλλουν. Το υψηλότερο δυναμικό ηλεκτραρνητικότητας σημαίνει ότι αυτά τα άτομα οξυγόνου προσελκύουν περισσότερα ηλεκτρόνια από τα άτομα υδρογόνου, δίνοντας τους δεσμούς – ΟΗ και ένα συνολικό αρνητικό φορτίο. Άλλα πολικά μόρια περιλαμβάνουν το διοξείδιο του θείου και το υδρόθειο.
Τα μη πολικά μόρια περιλαμβάνουν μόρια όπως το όζον, το οξυγόνο και το άζωτο. Στην περίπτωση αυτών των μη πολικών μορίων αποτελούνται από ένα μόνο στοιχείο και αναφέρονται ως ομοπυρηνικά μόρια. Υπάρχουν μόρια που είναι ομοπύρηνα και περιλαμβάνουν διοξείδιο του άνθρακα, τετραχλωράνθρακα και μεθάνιο. Ουσίες όπως η βενζίνη, το τολουόλιο και το οξικό οξύ τείνουν επίσης να είναι μη πολικές.
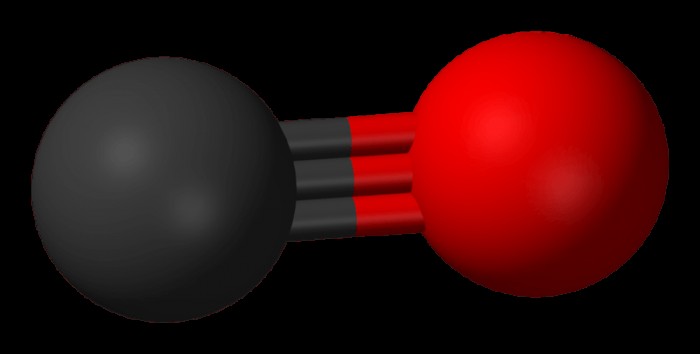
Ενώ το μονοξείδιο του άνθρακα είναι ένα πολικό μόριο, οι περισσότερες ενώσεις του άνθρακα είναι μη πολικές, με τη μοναδική δομή του μονοξειδίου του άνθρακα να το καθιστά πολικό μόριο και εξαίρεση σε αυτόν τον κανόνα. Το μονοξείδιο του άνθρακα έχει μια διαφορά ηλεκτραρνητικότητας μεταξύ των μορίων οξυγόνου και άνθρακα αρκετά μεγάλη ώστε το μόριο να έχει διαφορά στα φορτία και να είναι πολικό. Ένας άλλος τρόπος με τον οποίο το μονοξείδιο του άνθρακα είναι ασυνήθιστο είναι ότι ενώ τα περισσότερα γραμμικά μόρια είναι μη πολικά, το μονοξείδιο του άνθρακα είναι πολικό. Άλλα μη πολικά μόρια περιλαμβάνουν τα ευγενή αέρια και τα αλκίνια. Τα ευγενή αέρια, που μερικές φορές ονομάζονται αδρανή αέρια, είναι μη πολικά επειδή αποτελούνται μόνο από άτομα του ίδιου στοιχείου, ενώ τα αλκίνια μπορούν να διαλυθούν στο νερό. Το ήλιο, το κρυπτό, το αργό και το νέο είναι όλα παραδείγματα ευγενών αερίων.
Οι τιμές ηλεκτραρνητικότητας ενός ατόμου μορίων είναι κάτι που καθορίζει εάν ένα μόριο είναι ή όχι μη πολικό ή πολικό. Εξάλλου, τα ηλεκτρόνια μοιράζονται εξίσου μεταξύ των ατόμων, εάν υπάρχουν μεγάλες διαφορές στις τιμές ηλεκτραρνητικότητας, και εάν οι τιμές μοιράζονται άνισα, το μόριο θα έχει ένα καθαρό αρνητικό φορτίο σε μια περιοχή και ένα καθαρό θετικό φορτίο σε μια άλλη, καθιστώντας το πολικό. Θυμηθείτε ότι η συνολική ηλεκτραρνητικότητα, η ηλεκτραρνητικότητα για όλους τους δεσμούς, πρέπει να λαμβάνεται υπόψη. Ένας από τους κύριους παράγοντες που επηρεάζουν την πολικότητα ενός μορίου είναι η δομή/γεωμετρία του μορίου. Εάν τα φορτία του μορίου περιστρέφονται όλα γύρω από ένα κεντρικό άτομο, κατά πάσα πιθανότητα είναι ομοιόμορφα κατανεμημένα και ως αποτέλεσμα το μόριο θα είναι μη πολικό. Κατά την πρόβλεψη της πολικότητας ενός μορίου πρέπει να λαμβάνονται υπόψη τόσο η συνολική ηλεκτραρνητικότητα όσο και η δομή του μορίου.