Φόρτιση και φόρμουλα ιόντων αλουμινίου

Η χρέωση ενόςιόντος αλουμινίου είναι συνήθως 3+. Αυτό συμβαίνει επειδή ο ατομικός αριθμός του στοιχείου είναι 13, αντικατοπτρίζοντας το γεγονός ότι έχει 13 ηλεκτρόνια και 13 πρωτόνια. Το κέλυφος σθένους του αλουμινίου έχει τρία ηλεκτρόνια και σύμφωνα με τον κανόνα της οκτάδας, αυτά τα τρία ηλεκτρόνια χάνονται με αποτέλεσμα μόλις 10 ηλεκτρόνια και 13 πρωτόνια. Στη συνέχεια, το αλουμίνιο έχει τρία πλεονάζοντα πρωτόνια, επομένως το φορτίο ενός ιόντος αλουμινίου βάσης είναι 3+.
Αυτή είναι η γρήγορη απάντηση σχετικά με το πώς η φόρτιση του αλουμινίου είναι 3+. Ωστόσο, για να κατανοήσουμε καλύτερα τη σχέση μεταξύ ιόντων, ιονισμού και των διαφορετικών στοιχείων, απαιτείται μια πιο προσεκτική ματιά τόσο στα θετικά όσο και στα αρνητικά ιόντα.
Στοιχεία για το αλουμίνιο
Το αλουμίνιο είναι ένα μαλακό μέταλλο στην ομάδα του βορίου στον περιοδικό πίνακα των στοιχείων. Αντιπροσωπεύεται με το σύμβολο «Al» και έχει ατομικό αριθμό 13. Το αλουμίνιο είναι ένα εξαιρετικά άφθονο στοιχείο, στην πραγματικότητα, είναι το πιο άφθονο μεταλλικό στοιχείο στον φλοιό της γης. Μαζί με το σίδηρο, το αλουμίνιο είναι το πιο συχνά χρησιμοποιούμενο μέταλλο. Το 2016, η παγκόσμια παραγωγή αλουμινίου ήταν περίπου 59 εκατομμύρια μετρικοί τόνοι. Το αλουμίνιο χρησιμοποιείται για μια μεγάλη ποικιλία διαφορετικών σκοπών, συμπεριλαμβανομένης της δημιουργίας οχημάτων, μπαταριών και υλικών συσκευασίας, καθώς και για την κατασκευή κτιρίων και τη δημιουργία μαγειρικών σκευών.
Η δομή ενός ατόμου
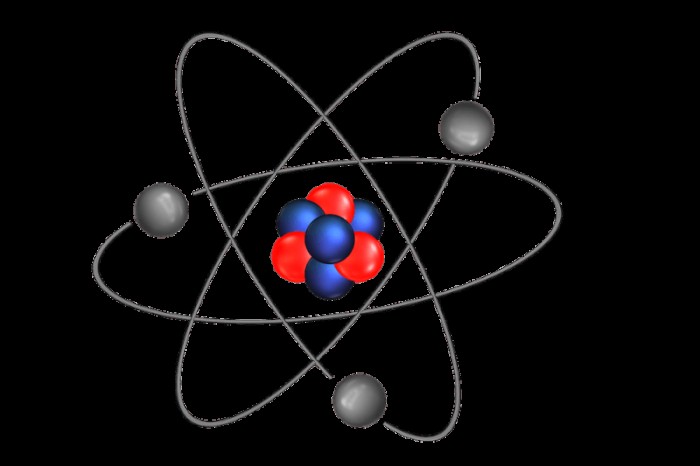
Τα άτομα αποτελούνται από τρία βασικά μέρη, χωρισμένα σε δύο διακριτές περιοχές. Τα νετρόνια, τα ηλεκτρόνια και τα πρωτόνια είναι τα τρία συστατικά μέρη ενός ατόμου. Τα πρωτόνια είναι θετικά φορτισμένα υποατομικά σωματίδια, ενώ τα νετρόνια είναι υποατομικά σωματίδια που δεν έχουν φορτίο. Τα νετρόνια και τα πρωτόνια έχουν μάζες περίπου ίσες. Τα νετρόνια ζυγίζουν περίπου 1,67 x 10 γραμμάρια.
Η πρώτη περιοχή του ατόμου είναι ο πυρήνας, το κέντρο του ατόμου. Ο πυρήνας αποτελείται από νετρόνια και πρωτόνια. Έξω από τον πυρήνα βρίσκεται η τροχιακή περιοχή, που αποτελείται από ηλεκτρόνια που περιφέρονται γύρω από τον πυρήνα. Τα εξωτερικά τμήματα του ατόμου αναφέρονται ως κελύφη ηλεκτρονίων. Αυτά τα κελύφη ηλεκτρονίων συγκρατούν ηλεκτρόνια σε τροχιά και ένα άτομο μπορεί να έχει πολλαπλά κελύφη ηλεκτρονίων.
Τα άτομα έχουν διαφορετικές ιδιότητες με βάση το πώς είναι διατεταγμένα τα απλά συστατικά σωματίδια. Ο ατομικός αριθμός ενός στοιχείου βασίζεται στον αριθμό των πρωτονίων που έχει ένα άτομο αυτού του στοιχείου. Εάν ένα άτομο ενός στοιχείου είναι ουδέτερο, αυτό σημαίνει ότι έχει τον ίδιο αριθμό ηλεκτρονίων και πρωτονίων. Ο αριθμός των νετρονίων που έχει ένα στοιχείο ορίζει τα ισότοπα αυτού του στοιχείου. Τα ισότοπα είναι απλώς διαφορετικές παραλλαγές των ατόμων του πρώτου στοιχείου, που διαφέρουν μόνο στον αριθμό των νετρονίων που διαθέτει το άτομο.
Όταν λαμβάνονται μαζί, ο μαζικός αριθμός του στοιχείου καθορίζεται από τον αριθμό των πρωτονίων και των νετρονίων σε ένα άτομο του στοιχείου. Τα ισότοπα ενός στοιχείου έχουν μαζικούς αριθμούς που είναι ελαφρώς διαφορετικοί επειδή διαφέρουν ως προς τον αριθμό των νετρονίων τους. Η ατομική μάζα ενός στοιχείου διακρίνεται λαμβάνοντας τον μέσο όρο των αριθμών μάζας για τα διαφορετικά ισότοπα ενός στοιχείου. Ενώ τα ισότοπα είναι μορφές στοιχείων που διαφέρουν λόγω του διαφορετικού αριθμού νετρονίων στους πυρήνες, τα ιόντα είναι άτομα που έχουν καθαρό ηλεκτρικό φορτίο επειδή το άτομο βάσης του στοιχείου έχει αποκτήσει ή χάσει ένα ή περισσότερα ηλεκτρόνια.
Ορισμός ενός ιόντος
Τα ιόντα είναι μόρια ή άτομα που έχουν χάσει ή αποκτήσει ένα ή περισσότερα ηλεκτρόνια από το κέλυφος σθένους τους, το οποίο καταλήγει να τους δίνει ένα καθαρό αρνητικό ή θετικό ηλεκτρικό φορτίο. Για να το θέσω αλλιώς, τα ιόντα έχουν έναν ανισορροπημένο αριθμό ηλεκτρονίων και πρωτονίων σε ένα χημικό είδος. Ο όρος ιόν επινοήθηκε αρχικά από τον Άγγλο χημικό Michael Faraday για να περιγράψει χημικές ουσίες που ταξιδεύουν από το ένα ηλεκτρόδιο στο άλλο.
Αρνητικά και θετικά ιόντα
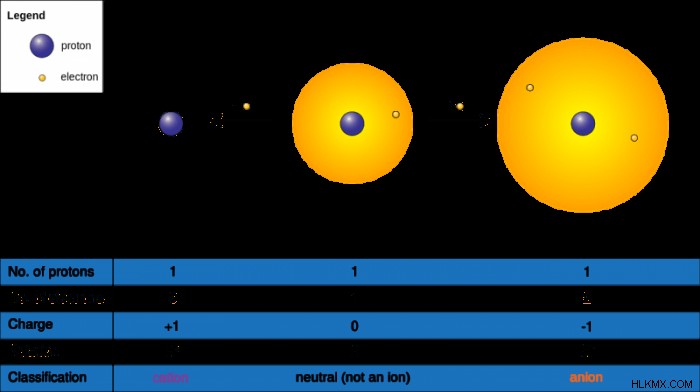
Τα καθαρά άτομα δεν έχουν ηλεκτρικό φορτίο και αυτό οφείλεται στο γεγονός ότι τα άτομα διαθέτουν ίσο αριθμό ηλεκτρονίων και πρωτονίων. Τα ηλεκτρόνια έχουν αρνητικό φορτίο, ενώ τα πρωτόνια είναι υποατομικά σωματίδια με θετικό φορτίο. Ωστόσο, ορισμένες καταστάσεις και χημικές αλληλεπιδράσεις μπορεί να αναγκάσουν τα άτομα να αποβάλουν ένα ηλεκτρόνιο ή να αποκτήσουν ένα ηλεκτρόνιο, γεγονός που επηρεάζει το καθαρό φορτίο τους. Σε αυτήν την περίπτωση, τα άτομα που επηρεάζουν το καθαρό τους φορτίο γίνονται ιόντα.
Για παράδειγμα, ένα άτομο αλουμινίου έχει ατομικό αριθμό 13, που αντικατοπτρίζει το γεγονός ότι έχει 13 πρωτόνια. Κάθε πρωτόνιο έχει θετικό φορτίο, και δεδομένου ότι τα περισσότερα άτομα είναι ουδέτερα, συνεπάγεται ότι για κάθε πρωτόνιο υπάρχει ένα ηλεκτρόνιο, για 13 ηλεκτρόνια και 13 πρωτόνια. Αυτό ισχύει για όλα τα άτομα αλουμινίου. Τα μέταλλα είναι ικανά να σχηματίζουν ιόντα χάνοντας ηλεκτρόνια, και αυτό ισχύει για το αλουμίνιο που μπορεί να χάσει τρία ηλεκτρόνια.
Εάν το αποτέλεσμα μιας αλλαγής στο φορτίο παράγει ένα θετικό ιόν, το ιόν αναφέρεται ως κατιόν. Τα κατιόντα υποδηλώνονται με το στοιχείο που τα περιλαμβάνει, επομένως σε αυτήν την περίπτωση, υπάρχει ένα κατιόν αλουμινίου.
Στο συγκεκριμένο παράδειγμα αλουμινίου, το αλουμίνιο είχε ένα αρχικό φορτίο μηδέν, χάρη στα 13 ηλεκτρόνια και τα 13 πρωτόνια που ακυρώνουν το ένα. Όταν ένα άτομο αλουμινίου γίνεται ιόν, ρίχνει τρία ηλεκτρόνια. Δεδομένου ότι υπάρχουν μόνο 10 ηλεκτρόνια, η τιμή τους αφαιρείται από τον αριθμό των πρωτονίων και η διαφορά είναι θετικό τρία. Επομένως, ένα ιόν αλουμινίου έχει θετικό φορτίο 3, που φαίνεται ως 3+. Ορισμένα βιβλία χημείας μπορεί να βάζουν το σύμβολο «+» πριν από τον αριθμό και όχι μετά τον αριθμό. Η κατιονική έκδοση του αλουμινίου μπορεί επίσης να εμφανιστεί με ένα σύμβολο συν και έναν εκθέτη αριθμό:Al ή Al.
Όσον αφορά τα αρνητικά φορτισμένα ιόντα, αυτά αναφέρονται ως ανιόντα. Τα ανιόντα είναι το αποτέλεσμα μιας αλλαγής φορτίου που αφήνει ένα αρνητικό φορτίο συνολικά. Όπως θα περίμενε κανείς, η αναπαράσταση ενός ανιόντος είναι με αρνητικό πρόσημο αντί για θετικό πρόσημο του κατιόντος. Για παράδειγμα, το Cl- είναι ένα ανιόν χλωρίου που δημιουργείται όταν το χλώριο συλλαμβάνει ένα άλλο ηλεκτρόνιο, το οποίο του δίνει ένα καθαρό φορτίο -1. Σε αντίθεση με τα κατιόντα, τα οποία ονομάζονται απλώς κατιόντα των αντίστοιχων στοιχείων, τα ανιόντα έχουν ένα ειδικό σχήμα ονομασίας (άρα ένα ανιόν χλωρίου δεν αναφέρεται ως ιόν χλωρίου).
Εάν ένα ιόν αποτελείται από ένα μεμονωμένο στοιχείο, τότε αυτό συμβολίζεται με την προσθήκη της κατάληξης «-ide» στο όνομα του στοιχείου, έτσι ένα ανιόν χλωρίου γίνεται χλωρίδιο και ένα ιόν άνθρακα και αζώτου ή CN- γίνεται κυάνιο. Στις περισσότερες περιπτώσεις, το επίθημα «-ide» είναι αρκετό. Ωστόσο, εάν υπάρχουν ιόντα που αποτελούνται από περισσότερα από ένα στοιχεία (αναφέρονται ως πολυατομικά ανιόντα) ή ανιόντα που περιέχουν οξυγόνο, χρειάζονται περισσότερα επιθήματα και προθέματα. Το επίθημα «-ate» εφαρμόζεται σε οξυανιόντα που έχουν τον τυπικό αριθμό ατόμων οξυγόνου μέσα τους. Εν τω μεταξύ, το επίθημα "-ite" εφαρμόζεται σε οξυανιόντα που έχουν ένα λιγότερο οξυγόνο από τον κανόνα.
Για οξυανιόντα που έχουν δύο λιγότερα οξυγόνα από τον κανόνα, αλλά έχουν ένα ελάχιστο φορτίο, η βάση του στοιχείου προσαρτάται στη μέση ενός προθέματος "-hypo" και ενός επιθέματος "-ite". Εν τω μεταξύ, για οξυανιόντα που έχουν ένα άτομο οξυγόνου περισσότερο από το τυπικό, αλλά εξακολουθούν να έχουν κανονικό φορτίο, το πρόθεμα ανά προσαρτάται σε αυτό καθώς και το επίθημα «-ate». Τέλος, στα ανιόντα που έχουν θείο που υποκαθιστά το οξυγόνο δίνεται το πρόθεμα «θειο-».
Διαφορετικά στοιχεία είναι ικανά να δημιουργούν ιόντα με πολλούς διαφορετικούς τρόπους, κάτι που δεν προκαλεί έκπληξη όταν εξετάζουμε πόσες διαφορετικές οικογένειες υπάρχουν στον περιοδικό πίνακα των στοιχείων. Ωστόσο, επειδή είναι δυνατό αυτά τα πολλά στοιχεία να ομαδοποιηθούν σε οικογένειες (δεδομένης της ομάδας ή της στήλης στην οποία βρίσκονται στον περιοδικό πίνακα), είναι πιθανό να προβλεφθεί ο τρόπος με τον οποίο αυτά τα στοιχεία θα δημιουργήσουν ιόντα. Μπορούν να χρησιμοποιηθούν μερικά ευρετικά για την πρόβλεψη της δημιουργίας ιόντων.
Γενικά, τα αλκαλικά μέταλλα, αυτά που βρίσκονται στην ομάδα ένα του περιοδικού πίνακα δημιουργούν 1+ ιόντα όταν ιονίζονται. Για παράδειγμα, το Li+ είναι το ιόν του λιθίου. Τα μέταλλα των αλκαλικών γαιών, αυτά που βρίσκονται στην ομάδα 2 του περιοδικού πίνακα, ιονίζονται σε 2+ κατιόντα. Το βηρύλλιο παράγει ιόντα Be 2+. Τα περισσότερα από τα μέταλλα που βρίσκονται στην ομάδα 3 του περιοδικού πίνακα, όπως το ίνδιο, το γάλλιο και το αλουμίνιο ιονίζονται για να σχηματίσουν 3+ κατιόντα. Το κατιόν αλουμινίου, όπως φαίνεται παραπάνω, ορίζεται ως Al 3+. Τα μεταλλοειδή και τα αμέταλλα της ομάδας 6 όπως το οξυγόνο, το τελλούριο, το σελήνιο και το θείο παράγουν 2-ανιόντα όταν ιονίζονται. Για παράδειγμα, η σταθερή, ιονισμένη κατάσταση του οξυγόνου δίνεται ως O2-. Τα στοιχεία που βρίσκονται στην ομάδα 7 του περιοδικού πίνακα παράγουν ανιόντα -1 όταν ιονίζονται. Για το λόγο αυτό, το ανιόν του φθορίου θα δοθεί ως Fl-.
Τα καθαρά μέταλλα, δηλαδή τα μη μεταβατικά μέταλλα, θα καταλήγουν πάντα να σχηματίζουν κατιόντα ή θετικά ιόντα. Στην πραγματικότητα, ένα από τα καθοριστικά χαρακτηριστικά των μετάλλων είναι ότι τα μέταλλα τείνουν να απορρίπτουν ηλεκτρόνια. Αντίθετα, τα μέταλλα μετάπτωσης ή τα μεταλλοειδή μπορεί να σχηματίσουν ιόντα με διάφορες εντάσεις φορτίου και η ταξινόμηση των πολυάριθμων τρόπων σχηματισμού αυτών των κατιόντων είναι πιο περίπλοκη από τα καθαρά μέταλλα.
Ενώ τα μέταλλα συνήθως σχηματίζουν κατιόντα, τα αμέταλλα συνήθως αποκτούν ηλεκτρόνια και σχηματίζουν ανιόντα. Παρόμοια με τον τρόπο με τον οποίο τα μέταλλα χάνουν ηλεκτρόνια, μια καθοριστική ιδιότητα των αμέταλλων είναι ότι συχνά αποκτούν ηλεκτρόνια. Οι λόγοι που αυτά τα μέταλλα και τα αμέταλλα αποκτούν ή χάνουν ηλεκτρόνια έχουν να κάνουν με μια σειρά πολύπλοκων παραγόντων. Μερικοί από τους παράγοντες που επηρεάζουν τον ιονισμό των στοιχείων περιλαμβάνουν τον αριθμό των ηλεκτρονίων σθένους που έχει κάθε άτομο και τον χημικό δεσμό του κανόνα οκτάδας.




