Κατάλογος μετάλλων και μη μετάλλων
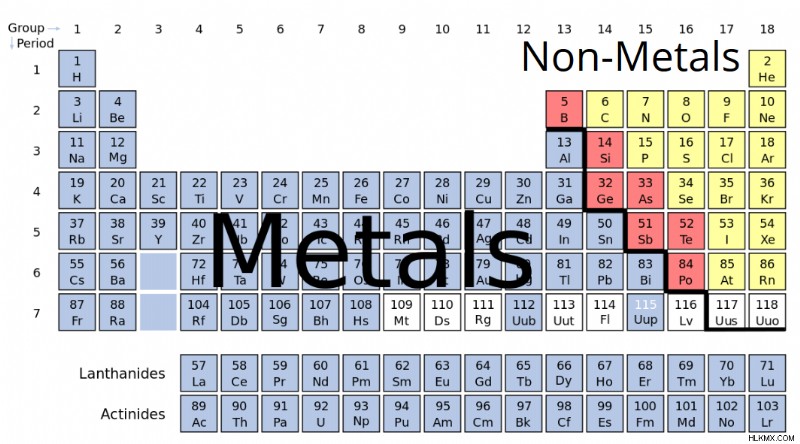
Η λίστα μετάλλων που συνθέτει τον περιοδικό πίνακα περιλαμβάνει σίδηρο, μόλυβδο, χρυσό, αλουμίνιο, πλατίνα, ουράνιο, ψευδάργυρο, λίθιο, νάτριο, κασσίτερο, ασήμι κ.λπ.
Η μη μέταλλα λ ο οποίος αποτελεί τον περιοδικό πίνακα περιλαμβάνει υδρογόνο, ήλιο, άνθρακα, θείο, άζωτο, οξυγόνο, ραδόνιο, νέο, άλλα αλογόνα και ευγενή αέρια κ.λπ.
Όταν μελετάμε τα στοιχεία, είναι σημαντικό να γνωρίζουμε ποια στοιχεία είναι μέταλλα και ποια όχι. Εάν προσπαθείτε να μάθετε να διακρίνετε τα μέταλλα από τα μη μέταλλα, μια λίστα και οι χρήσεις τους είναι ένας καλός τρόπος για να τα αναλύσετε και να απομνημονεύσετε τη διαφορά μεταξύ των δύο. Τα καλά νέα είναι ότι τα περισσότερα στοιχεία είναι μέταλλα. Ένας χρήσιμος τρόπος προσέγγισης της μελέτης των στοιχείων είναι να διακρίνουμε αν είναι μεταλλικά ή μη. Τα μέταλλα έχουν κοινές ιδιότητες. Έτσι, γνωρίζοντας ποιες είναι αυτές οι ιδιότητες είναι ένας καλός τρόπος για να ξεκινήσουμε τη μελέτη μας.
Τι είναι ένα μέταλλο;
Όπως αναφέρθηκε στην εισαγωγή, τα περισσότερα στοιχεία είναι μέταλλα ή, τουλάχιστον, μπορούν να θεωρηθούν ως τέτοια. Γνωρίζοντας ποιες είναι ή όχι, θα μας βοηθήσει να τις ομαδοποιήσουμε σωστά. Πριν προχωρήσουμε στην πλήρη λίστα των μετάλλων, είναι σημαντικό να ορίσουμε τι είναι μέταλλο. Υπάρχουν πέντε διαφορετικά είδη μετάλλων:
- Μέταλλα αλκαλίων
- Αλκαλικές γαίες
- Μέταλλα μετάβασης
- Λανθανίδες
- Ακτινίδες
Όλα τα μεταλλικά στοιχεία τοποθετούνται μαζί στον περιοδικό πίνακα.
Υπάρχουν πολλές ιδιότητες που κάνουν τα περισσότερα στοιχεία μέταλλα. Ένα στοιχείο πρέπει να μοιράζεται αρκετές από αυτές τις ιδιότητες προκειμένου να θεωρηθεί μέταλλο. Είναι σημαντικό να εξοικειωθείτε με αυτές τις διαφορετικές ιδιότητες. Δεν είναι κοινές όλες οι ιδιότητες από όλα τα μέταλλα, αλλά όλα τα στοιχεία που έχουν πολλές από αυτές τις ιδιότητες μπορούν να θεωρηθούν μέταλλα.
Ποιες είναι οι κοινές ιδιότητες των μετάλλων;
Τα περισσότερα μέταλλα έχουν στερεή κατάσταση όταν βρίσκονται σε θερμοκρασία δωματίου. Η μόνη εξαίρεση σε αυτή την ιδιότητα, στην πραγματικότητα, είναι ο υδράργυρος. Ο υδράργυρος είναι το μόνο μέταλλο που είναι πάντα υγρό ανεξάρτητα από τη θερμοκρασία. Έτσι παραμένει σε υγρή παραμονή ακόμα και σε θερμοκρασία δωματίου. Γενικά, το σημείο τήξης των μετάλλων είναι υψηλό.
- Ένας άλλος τρόπος για να αναγνωρίσετε ένα μέταλλο είναι ότι τείνουν να είναι λαμπερά.
- Τα μέταλλα τείνουν επίσης να είναι καλός αγωγός της θερμότητας και του ηλεκτρισμού. Αλλά έχουν χαμηλές ενέργειες ιονισμού και χαμηλές ηλεκτραρνητικότητες. Μια άλλη σημαντική ιδιότητα που μοιράζονται πολλά μεταλλικά στοιχεία είναι ότι είναι ελατά. Αυτό σημαίνει ότι τα μέταλλα είναι σχετικά εύκολο να χωριστούν σε φύλλα.
- Επίσης, τα περισσότερα μέταλλα μπορούν να γίνουν σύρμα. Αυτό είναι που γνωρίζουμε ως όλκιμο.
- Με εξαίρεση το κάλιο, το λίθιο και το νάτριο, τα περισσότερα μέταλλα έχουν υψηλή πυκνότητα.
- Μία από τις κοινές και, ίσως, πιο αξιοσημείωτες ιδιότητες που μοιράζονται τα περισσότερα μεταλλικά στοιχεία είναι ότι διαβρώνονται όταν εκτίθενται σε θαλασσινό νερό ή στον αέρα.
- Τέλος, τα περισσότερα μεταλλικά στοιχεία χάνουν ηλεκτρόνια κατά τις αντιδράσεις.
Υπάρχει ένα μη μεταλλικό στοιχείο που μερικές φορές μπορεί να λειτουργήσει ως μέταλλο. Αυτό είναι το υδρογόνο που, όταν εκτίθεται είτε σε εξαιρετικά υψηλές είτε σε εξαιρετικά χαμηλές θερμοκρασίες, μπορεί να εμφανίσει μερικές από αυτές τις κοινές ιδιότητες.
Η πλήρης λίστα μετάλλων
Τώρα που έχουμε καθορίσει τις ιδιότητες που κάνουν τα περισσότερα στοιχεία του περιοδικού πίνακα σε μέταλλα, μπορούμε τώρα να παρουσιάσουμε την πλήρη λίστα των μεταλλικών στοιχείων:
| Στοιχείο | Σύμβολο | Αριθμός στον περιοδικό πίνακα |
| Λίθιο | Li | 3 |
| Βηρύλλιο | Be | 4 |
| Νάτριο | Όχι | 11 |
| Μαγνήσιο | Mg | 12 |
| Αλουμίνιο | Al | 13 |
| Κάλιο | K | 19 |
| Ασβέστιο | Περίπου | 20 |
| Σκάνδιο | Sc | 21 |
| Τιτάνιο | Τι | 22 |
| Βανάδιο | V | 23 |
| Chromium | Cr | 24 |
| Μαγγάνιο | Mn | 25 |
| Σίδερο | Φε | 26 |
| Κοβάλτιο | Συν | 27 |
| Νίκελ | Ni | 28 |
| Χαλκός | Cu | 29 |
| Ψευδάργυρος | Zn | 30 |
| Γάλλιο | Χα | 31 |
| Ρουβίδιο | Rb | 37 |
| Στρόντιο | Sr | 38 |
| Ύττριο | Ε | 39 |
| Ζιρκόνιο | Zr | 40 |
| Νιόβιο | Σημ. | 41 |
| Μολυβδαίνιο | Mo | 42 |
| Τεχνήτιο | Tc | 43 |
| Ρουθήνιο | Ru | 44 |
| Ρόδιο | Rh | 45 |
| Παλλάδιο | Pd | 46 |
| Ασημί | Ag | 47 |
| Κάδμιο | Cd | 48 |
| Ίνδιο | Σε | 49 |
| Κασσίτερος | Sn | 50 |
| Κάσιο | Cs | 55 |
| Βάριο | Ba | 56 |
| Λανθάνιο | La | 57 |
| Cerium | Ε | 58 |
| Πρασεοδύμιο | Pr | 59 |
| Νεοδύμιο | Δ | 60 |
| Προμέθιο | ΜΜ | 61 |
| Σαμάριο | Sm | 62 |
| Ευρώπιο | Ευ | 63 |
| Γαδολίνιο | Gd | 64 |
| Τέρβιο | Tb | 65 |
| Δυσπρόσιο | Dy | 66 |
| Χόλμιο | Ho | 67 |
| Έρβιο | Ε | 68 |
| Θούλιο | Tm | 69 |
| Υτέρβιο | Yb | 70 |
| Λουτέτιο | Λου | 71 |
| Χάφνιο | Hf | 72 |
| Ταντάλιο | Τα | 73 |
| Βολφράμιο | W | 74 |
| Ρήνιο | Re | 75 |
| Όσμιο | Λειτουργία | 76 |
| Ιρίδιο | I | 77 |
| Πλατινένιο | Pt | 78 |
| Χρυσός | Au | 79 |
| Ερμής | Hg | 80 |
| Θάλλιο | Tl | 81 |
| Προηγούμενος | PB | 82 |
| Βισμούθιο | Bi | 83 |
| Πολώνιο | Po | 84 |
| Φράγκιο | Fr | 87 |
| Ράδιο | Ra | 88 |
| Ακτίνιο | Ac | 89 |
| Θόριο | Θ | 90 |
| Πρωτακτίνιο | Πα | 91 |
| Ουράνιο | U | 92 |
| Ποσειδώνιο | Np | 93 |
| Πλουτώνιο | Pu | 94 |
| Americium | Π.μ. | 95 |
| Κούριο | cm | 96 |
| Βερκέλιο | Bk | 97 |
| Καλιφόρνιο | Πρ | 98 |
| Αϊνστάιν | Es | 99 |
| Φέρμιο | Fm | 100 |
| Μεντελέβιο | Md | 101 |
| Nobelium | Όχι | 102 |
| Λαυρένιο | Lr | 103 |
| Rutherfordium | Rf | 104 |
| Dubnium | Db | 105 |
| Seaborgium | Sg | 106 |
| Βόριο | Bh | 107 |
| Χάσιο | Υ | 108 |
| Meitnerium | Mt | 109 |
| Darmstadtium | Δ | 110 |
| Roentgenium | Rg | 111 |
| Κοπερνίκιο | Cn | 112 |
| Ununtrium | Uut | 113 |
| Flevorium | Fl | 114 |
| Livermorium | Lv | 116 |
Η πλήρης λίστα των μη μετάλλων
Τα μη μέταλλα μπορούν να οριστούν απλά έχοντας τις αντίθετες ιδιότητες των μετάλλων. Για παράδειγμα, δεν είναι ελατό, έχουν σχετικά χαμηλή πυκνότητα, είναι θαμπά και είναι κακοί αγωγοί θερμότητας και ηλεκτρισμού κ.λπ.
Ακολουθεί η πλήρης λίστα αν είναι μη μέταλλα:
| Στοιχείο | Σύμβολο στοιχείου | Αριθμός στον περιοδικό πίνακα |
| Υδρογόνο | H | 1 |
| Ήλιο | Αυτός | 2 |
| Άνθρακας | Γ | 6 |
| Άζωτο | Μ | 7 |
| Οξυγόνο | O | 8 |
| Φθόριο | F | 9 |
| Νέον | Όχι | 10 |
| Φώσφορος | P | 15 |
| Θείο | S | 16 |
| Χλώριο | Κλ | 17 |
| Αργόν | Ar | 18 |
| Σελήνιο | Δείτε | 34 |
| Βρώμιο | Br | 35 |
| Κρυπτόν | Kr | 36 |
| Ιώδιο | I | 53 |
| Xenon | Xe | 54 |
| Αστατίνη | Σε | 85 |
| Ραδόνιο | Rn | 117 |
| Oganesson | Og | 118 |
Ελπίζουμε αυτή η λίστα μετάλλων και μη μετάλλων στον περιοδικό πίνακα να βοηθήσει. Ενημερώστε μας στα σχόλια παρακάτω ποια αναζητούσατε συγκεκριμένα.




