Πώς Οργανώνεται και Τακτοποιείται ο Περιοδικός Πίνακας;
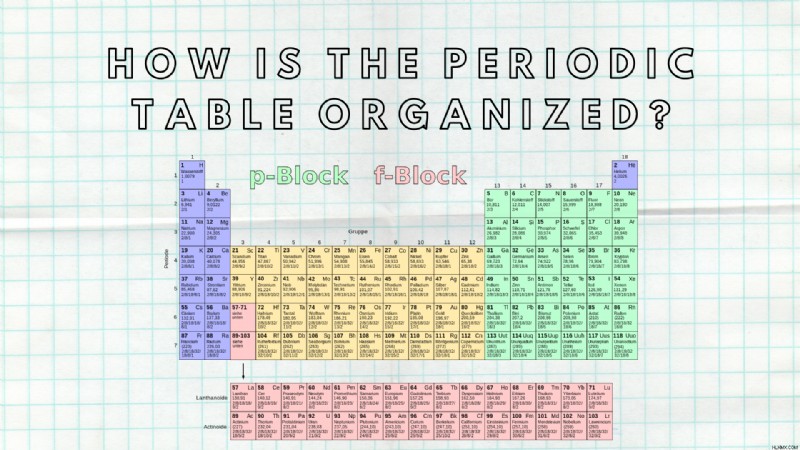
Ένα από τα πράγματα που πρέπει να μάθουν οι μαθητές των Φυσικών Επιστημών είναι ο περιοδικός πίνακας. Πώς οργανώνεται ο περιοδικός πίνακας ? Ο περιοδικός πίνακας είναι οργανωμένος σαν πλέγμα.
Σε αυτό το άρθρο, θα εξηγήσουμε πώς το πλέγμα οργανώνει τα στοιχεία. Η κατανόηση του τρόπου οργάνωσης των στοιχείων στο πλέγμα μπορεί να σας βοηθήσει να μάθετε τον περιοδικό πίνακα.
Η θέση καθενός από τα στοιχεία δεν είναι καθόλου τυχαία αλλά λόγω της ατομικής του δομής.
Δομή πλέγματος
Όπως συμβαίνει με όλες τις δομές πλέγματος, ο περιοδικός πίνακας έχει και στήλες από πάνω και κάτω και σειρές από αριστερά προς τα δεξιά. Οι σειρές και οι στήλες οργανώνονται με ακριβή χαρακτηριστικά. Τα στοιχεία που βρίσκονται στην ίδια στήλη ή στις ίδιες σειρές έχουν κοινά χαρακτηριστικά. Για παράδειγμα, το μαγνήσιο (Mg) και το νάτριο (Na) μοιράζονται ορισμένες ιδιότητες επειδή έχουν παρόμοιες διαμορφώσεις ηλεκτρονίων. Όταν τα στοιχεία έχουν παρόμοιες διαμορφώσεις ηλεκτρονίων, λέγεται ότι βρίσκονται στην ίδια περίοδο.
Αλλά αυτό αφορά μόνο τις σειρές. Οι στήλες οργανώνονται σε ομάδες στοιχείων που έχουν παρόμοιες χημικές ιδιότητες. Για παράδειγμα, το κάλιο (K) και το ρουβίδιο (Rb) βρίσκονται στην πρώτη σειρά, πράγμα που σημαίνει ότι βρίσκονται στην ίδια ομάδα.
Τα χημικά στοιχεία είναι επίσης διατεταγμένα σε αυξανόμενο αριθμό κατά ατομικό αριθμό.
Περίοδοι
Ας ερευνήσουμε τις περιόδους. Άλλωστε, έτσι πήρε το όνομά του ο περιοδικός πίνακας. Κάθε μία από τις σειρές από αριστερά προς τα δεξιά ονομάζεται τελεία. Αυτό σημαίνει ότι κάθε ένα από τα στοιχεία στη σειρά μοιράζεται παρόμοιες διαμορφώσεις ηλεκτρονίων με τα άλλα. Ή, με άλλα λόγια, καθένα από τα στοιχεία της ίδιας σειράς έχει τον ίδιο ακριβώς αριθμό ατομικών τροχιακών.
Αν κοιτάξετε όλα τα στοιχεία στην επάνω σειρά ή, με άλλα λόγια, τα στοιχεία της πρώτης περιόδου, θα δείτε ότι όλα έχουν ένα ατομικό τροχιακό για τα ηλεκτρόνια τους. Στη συνέχεια, τα στοιχεία της δεύτερης σειράς, ή δεύτερης περιόδου, χαρακτηρίζονται από δύο ατομικά τροχιακά στα ηλεκτρόνια τους. Για κάθε άλλη σειρά ή περίοδο, θα χρειαστεί να προσθέσετε ένα άλλο ατομικό τροχιακό.
Εάν γνωρίζετε πόσα ατομικά τροχιακά έχει ένα συγκεκριμένο στοιχείο, θα πρέπει να είστε σε θέση να γνωρίζετε σε ποια σειρά βρίσκεται. Ένας άλλος τρόπος για να το δούμε είναι ότι αν γνωρίζετε ποια σειρά καταλαμβάνει ένα στοιχείο στον περιοδικό πίνακα, θα πρέπει να μπορείτε να πείτε πόσα ατομικά τροχιακά έχει αυτό το συγκεκριμένο στοιχείο (1, 2, 3, κ.λπ.).
Ομάδες
Τώρα, ας δούμε τις ομάδες. Όλα τα χημικά στοιχεία της ίδιας στήλης (από πάνω προς τα κάτω) ανήκουν στην ίδια ομάδα. Στην πραγματικότητα, κάθε στήλη ονομάζεται ομάδα. Πώς όμως «ομαδοποιούνται» τα στοιχεία;
Όλα τα στοιχεία σε κάθε ομάδα έχουν τον ίδιο αριθμό ηλεκτρονίων στα εξωτερικά τροχιακά τους, γνωστά και ως ηλεκτρόνια σθένους. Αυτά τα ηλεκτρόνια είναι σημαντικά επειδή εμπλέκονται στους χημικούς δεσμούς με άλλα στοιχεία.
Πρέπει να διαβάζετε ομάδες από αριστερά προς τα δεξιά. Όλα τα στοιχεία της πρώτης στήλης, ή της ομάδας ένα, έχουν ένα ηλεκτρόνιο σθένους (ένα ηλεκτρόνιο στο εξωτερικό τους περίβλημα). Όλα τα στοιχεία της δεύτερης στήλης ή της ομάδας δύο έχουν δύο ηλεκτρόνια σθένους. Αλλά όλα τα στοιχεία της τρίτης ομάδας (ομάδα τρία), έχουν δεκατρία ηλεκτρόνια σθένους. Από εκεί και πέρα, πρέπει να προσθέσετε ένα ηλεκτρόνιο για κάθε ομάδα μέχρι να φτάσετε το 18. Απλώς, η καταμέτρηση των στηλών θα σας επιτρέψει να μάθετε πόσα ηλεκτρόνια έχει κάθε στοιχείο στο εξωτερικό του περίβλημα. Ωστόσο, υπάρχουν μερικές εξαιρέσεις σε αυτό, επειδή ορισμένα στοιχεία είναι μεταβατικά στοιχεία που προσθέτουν ηλεκτρόνια.
Υπάρχουν 8 διαφορετικές ομάδες:
- Η ομάδα 1 αφορά τα μέταλλα αλκαλίων:λίθιο (li), νάτριο (Na), κάλιο (K), ρουβίδιο (Rb), καίσιο (Cs) και φράγκιο (Fr).
- Η Ομάδα 2 αφορά τα μέταλλα των αλκαλικών γαιών:βηρύλλιο (Be), μαγνήσιο (Mg), ασβέστιο (Ca), στρόντιο (Sr), βάριο (Ba) και ράδιο (Ra). Το ράδιο δεν θεωρείται πάντα ως αλκαλικό στη γη λόγω της ραδιενέργειας του.
- Η ομάδα 13 είναι η ομάδα του βορίου:βόριο (B), αλουμίνιο (Al), γάλλιο (Ga), ίνδιο (In), θάλλιο (Tl) και, μερικές φορές, ununtrium (Uut).
- Η ομάδα 14 είναι η ομάδα άνθρακα:άνθρακας (C) πυρίτιο (Si), γερμάνιο (Ge), κασσίτερος (Sn), μόλυβδος (Pb) και, μερικές φορές, μη τετράδιο (Uuq).
- Η ομάδα 15 είναι η ομάδα αζώτου:Άζωτο (N), Φώσφορος (P), Αρσενικό (As), Αντιμόνιο (Sb), Βισμούθιο (Bi)m και, μερικές φορές ununpentium (UUp).
- Η ομάδα 16 είναι για τα Χαλκογόνα, που μερικές φορές είναι επίσης γνωστή ως ομάδα οξυγόνου:Οξυγόνο (O), θείο (S), σελήνιο (Se), τελλούριο (Te), πολώνιο (Po) και ununhexium (Uuh).
- Η Ομάδα 17 είναι για Αλογόνα:φθόριο (F), χλώριο (Cl), βρώμιο (Br), ιώδιο (I), αστίνη (At) και, μερικές φορές, μη σηπτικό (Uus).
- Η ομάδα 18 είναι για ευγενή αέρια:ήλιο (He), νέο (Ne), αργό (Ar), κρυπτό (Kr), ξένο (Xe) και ραδόνιο (Ra).
Κάθε μία από αυτές τις ομάδες έχει κοινές ιδιότητες που μπορούν να μελετηθούν με πολύ περισσότερες λεπτομέρειες, αλλά δεν είναι απαραίτητο να τις γνωρίζετε για να δείτε πώς είναι οργανωμένος ο περιοδικός πίνακας.
Τα δύο στοιχεία στην κορυφή
Πιθανότατα αναρωτιέστε για τα στοιχεία που βρίσκονται μόνα τους στην κορυφή:υδρογόνο (H) και ήλιο (He). Αυτά τα δύο είναι ειδικά στοιχεία για διαφορετικούς λόγους.
Το υδρογόνο (Η) δεν έχει ούτε ένα νετρόνιο στην ουδέτερη μορφή του, μόνο ένα πρωτόνιο και ένα ηλεκτρόνιο. Τώρα, το ατομικό υδρογόνο πρέπει να συνδυαστεί με άλλα στοιχεία για να γεμίσει το εξωτερικό του περίβλημα.
Το Ήλιο (Αυτός) είναι μοναδικό μεταξύ όλων των στοιχείων. Έχει μόνο δύο ηλεκτρόνια στο εξωτερικό του τροχιακό, γνωστό και ως κέλυφος σθένους. Όλα τα άλλα ευγενή αέρια (ομάδα 18) έχουν οκτώ ηλεκτρόνια στην εξωτερική τους τροχιακή ή στιβάδα σθένους. Λοιπόν, γιατί η ομάδα ηλίου είναι με νέο (Ne), αργό (Ar), κρυπτό (Kr), ξένο (Xe) και ραδόνιο (Ra); Επειδή όλα έχουν ένα κοινό χαρακτηριστικό:τα αντίστοιχα κελύφη σθένους τους είναι γεμάτα.
Έτσι είναι οργανωμένος ο περιοδικός πίνακας. Κατανοώντας ότι η θέση καθενός από τα στοιχεία είναι χρήσιμη για την κατανόηση των ιδιοτήτων τους. Εάν προσπαθείτε να απομνημονεύσετε τον περιοδικό πίνακα ή εάν πρέπει να μελετήσετε τα στοιχεία ως μέρος μιας επιστημονικής ομάδας, γνωρίζοντας ότι οι θέσεις των στοιχείων δεν είναι τυχαίες, αλλά ακολουθούν μια πολύ αυστηρή λογική, μπορεί να σας βοηθήσει στις ακαδημαϊκές σας προσπάθειες.




