Το νερό είναι πολικό ή μη;
Το νερό είναι ένα πολικό μόριο επειδή η ηλεκτραρνητικότητα του οξυγόνου είναι υψηλότερη από εκείνη του υδρογόνου, που σημαίνει ότι η πυκνότητα των ηλεκτρονίων μετατοπίζεται προς το άτομο οξυγόνου στο μόριο.
Το νερό είναι ένα πολικό μόριο επειδή το οξυγόνο του είναι έντονα ηλεκτραρνητικό και, ως εκ τούτου, τραβά το ζεύγος ηλεκτρονίων προς το μέρος του (μακριά από τα δύο άτομα υδρογόνου), αποκτώντας έτσι ένα ελαφρώς αρνητικό φορτίο.
Η πολικότητα ενός μορίου δεν εξαρτάται μόνο από τα συστατικά του άτομα, αλλά και από το πώς είναι διατεταγμένα γύρω από το κεντρικό άτομο, δηλαδή τη χωρική διάταξη αυτών των ατόμων. Για να το κατανοήσουμε καλύτερα, ας συζητήσουμε το θέμα με περισσότερες λεπτομέρειες.
Τι κάνει ένα μόριο πολικό;
Η πολικότητα ενός μορίου σχετίζεται με τη μετατόπιση των ηλεκτρονίων σε μια συγκεκριμένη κατεύθυνση. Αυτό, με τη σειρά του, εξαρτάται από την πολικότητα των δεσμών που υπάρχουν στο μόριο, καθώς αυτοί οι δεσμοί περιέχουν επίσης ηλεκτρόνια.
Μέσα σε ένα μόριο, το άτομο με την υψηλότερη ισχύ να προσελκύει ηλεκτρόνια προς τον εαυτό του (δηλαδή, είναι πιο ηλεκτραρνητικό από το άλλο άτομο) θα αποκτήσει ένα ελαφρύ αρνητικό φορτίο στον εαυτό του και ο δεσμός μεταξύ των δύο ατόμων θα γίνει πολικός.
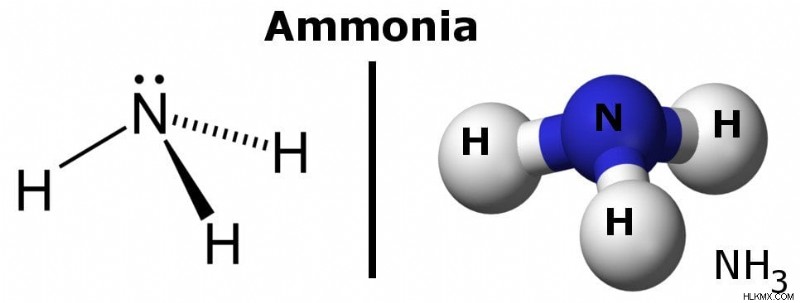
Η αμμωνία είναι ένα πολικό μόριο επειδή έχει περιοχές ελαφρών αρνητικών και θετικών φορτίων.
Συνολικά, θα μπορούσατε να πείτε ότι η πυκνότητα ηλεκτρονίων ενός πολικού δεσμού συσσωρεύεται προς το ένα άκρο του δεσμού, με αποτέλεσμα αυτό το άκρο να έχει ένα ελαφρύ αρνητικό φορτίο, ενώ το άλλο άκρο έχει ένα ελαφρύ θετικό φορτίο. Αυτό κάνει ένα μόριο πολικό.
Ομοίως, εάν ένα μόριο δεν έχει περιοχές θετικού και αρνητικού φορτίου, θεωρείται μη πολικό.
Ωστόσο, ένα ενδιαφέρον πράγμα που πρέπει να σημειωθεί είναι ότι όσο μεγαλύτερη είναι η διαφορά ηλεκτραρνητικότητας, τόσο πιο πολικός θα είναι ο δεσμός μέσα σε ένα μόριο. Οι καρβονυλικές ενώσεις είναι πολικές επειδή ο άνθρακας καρβονυλίου είναι ελαφρώς θετικός. Επομένως, το διοξείδιο του άνθρακα, το οποίο περιέχει έναν θετικό άνθρακα και δύο μερικώς αρνητικά οξυγόνα, δεν θα πρέπει να είναι πολικό;
Λοιπόν, το διοξείδιο του άνθρακα αποτελείται από δύο άτομα οξυγόνου συνδεδεμένα με ένα άτομο άνθρακα. Τα άτομα οξυγόνου είναι πολύ πιο ηλεκτραρνητικά από τα άτομα άνθρακα, και ως εκ τούτου, θα πρέπει να διατηρούν ένα μερικώς αρνητικό φορτίο, ενώ το άτομο άνθρακα θα πρέπει να είναι ελαφρώς θετικά φορτισμένο. Ωστόσο, είναι αρκετά ενδιαφέρον ότι αυτό δεν συμβαίνει.
Ρίξτε μια ματιά στον δομικό τύπο του διοξειδίου του άνθρακα:
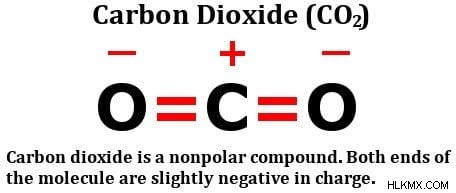
Αποτελείται από δύο εξίσου ηλεκτραρνητικά άτομα οξυγόνου, ναι, αλλά κοιτάξτε πώς αυτά τα άτομα είναι διατεταγμένα γύρω από το άτομο άνθρακα. Και οι δύο στέκονται σε τέλειες γωνίες 180 μοιρών από τον άνθρακα. Κατά συνέπεια, τραβούν την πυκνότητα ηλεκτρονίων από τον άνθρακα με ίση δύναμη σε αντίθετες κατευθύνσεις. Το καθαρό αποτέλεσμα είναι ότι η πυκνότητα ηλεκτρονίων στο άτομο άνθρακα παραμένει ανεπηρέαστη, γεγονός που καθιστά το μόριο διοξειδίου του άνθρακα μη πολικό.
Το διοξείδιο του άνθρακα είναι ένα εξαιρετικό παράδειγμα του πώς η γεωμετρία ενός μορίου παίζει καθοριστικό ρόλο στον προσδιορισμό του αν είναι πολικό ή μη. Τώρα, ας ρίξουμε μια ματιά σε ένα μόριο νερού:
Γιατί το νερό είναι πολικό;
Ο χημικός τύπος του νερού είναι Η20, που σημαίνει ότι περιέχει δύο άτομα υδρογόνου και ένα άτομο οξυγόνου. Τα άτομα υδρογόνου αποτελούνται μόνο από ένα ηλεκτρόνιο στο περίβλημά τους, ενώ το άτομο οξυγόνου έχει 6 ηλεκτρόνια σθένους.
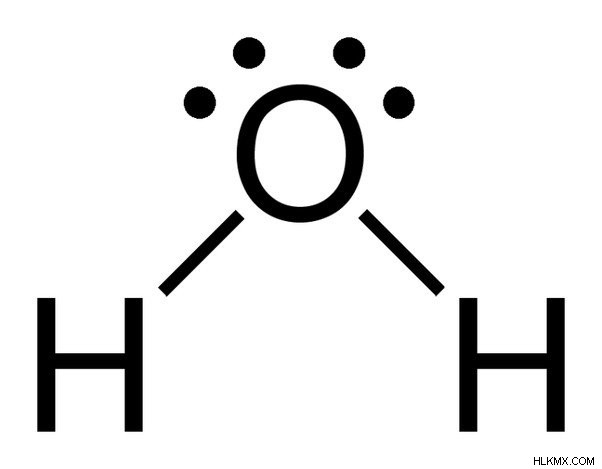
Παρατηρήστε τα 2 μεμονωμένα ζεύγη ηλεκτρονίων στο άτομο οξυγόνου στο νερό.
Δεδομένου ότι το οξυγόνο έχει 6 ηλεκτρόνια στο κέλυφος σθένους του, μοιράζεται ένα ηλεκτρόνιο με κάθε άτομο υδρογόνου. Με αυτόν τον τρόπο, μένει με 4 αδέσμευτα ηλεκτρόνια στα 2 τροχιακά του. Αυτά τα συνδεδεμένα και μη δεσμευμένα ζεύγη ηλεκτρονίων διατάσσονται σε τετραεδρικό σχήμα γύρω από το οξυγόνο, γι' αυτό και οι δύο δεσμοί φαίνεται να έχουν λυγισμένο σχήμα.
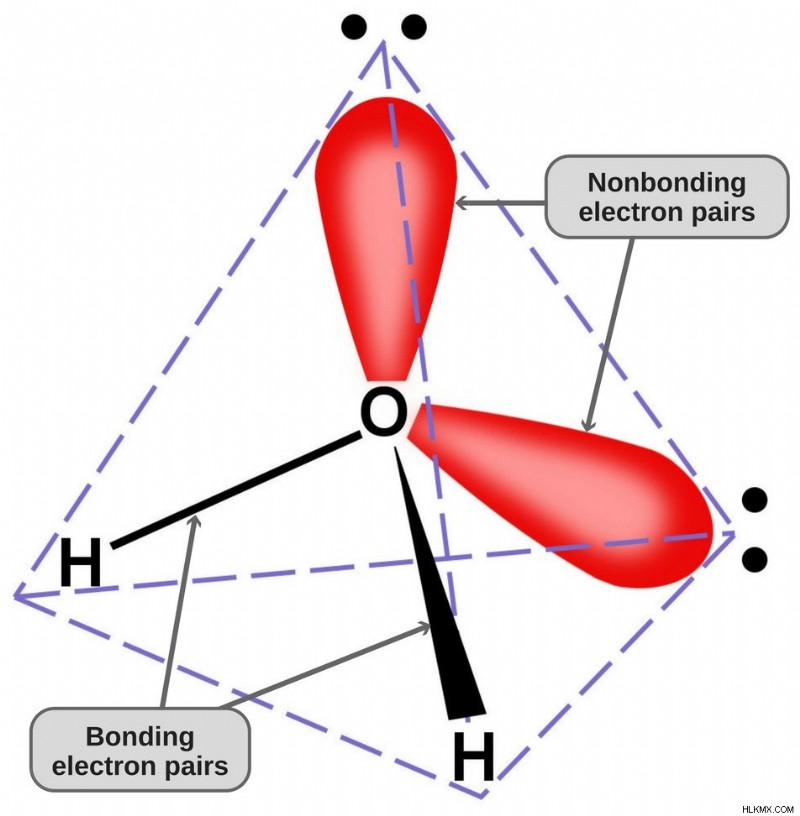
Η τετραεδρική γεωμετρία του μορίου του νερού.
Τώρα, και τα δύο άτομα οξυγόνου και υδρογόνου έχουν διαφορετικές ηλεκτραρνητικότητες (η τιμή ηλεκτραρνητικότητας του υδρογόνου είναι 2,1, ενώ η ηλεκτραρνητικότητα του οξυγόνου είναι 3,5). Επομένως, και οι δύο δεσμοί είναι πολικοί. Δεδομένου ότι το οξυγόνο είναι πιο ηλεκτραρνητικό από το υδρογόνο, η πυκνότητα των ηλεκτρονίων μετατοπίζεται προς το οξυγόνο και στους δύο αυτούς δεσμούς, καθιστώντας έτσι την περιοχή γύρω από το οξυγόνο πιο αρνητική από τις περιοχές γύρω από τα δύο άτομα υδρογόνου.
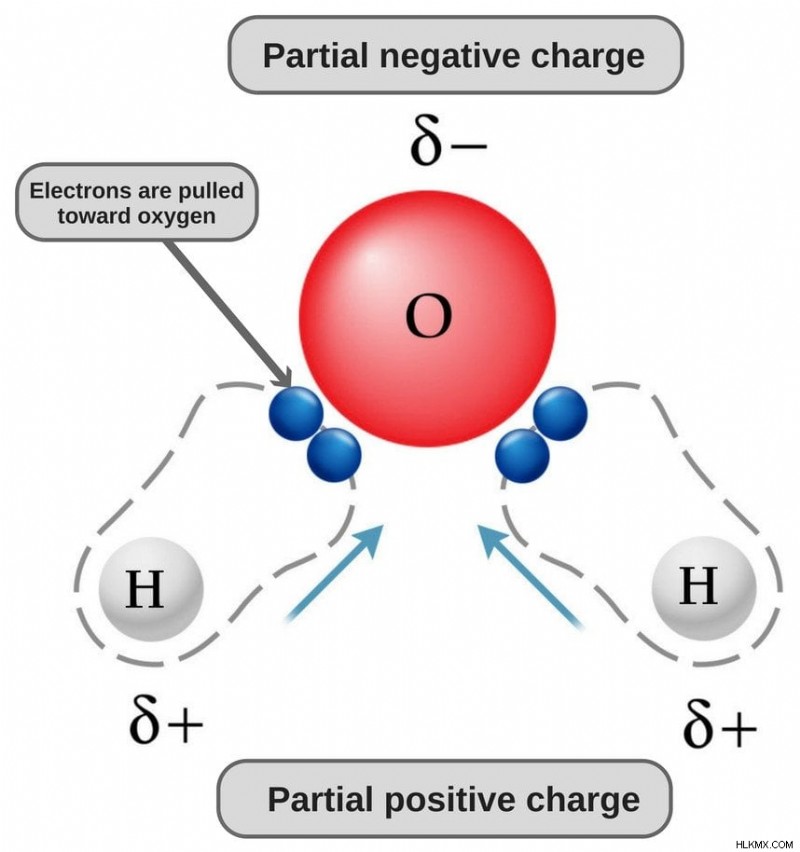
Αυτός είναι ο λόγος που το μόριο του νερού γίνεται πολικό!




