Πολικότητα του νερού – Γιατί το νερό είναι πολικό;
Βασικές έννοιες
Το νερό είναι μια από τις πιο άφθονες ουσίες στη Γη, καλύπτοντας το 71% της επιφάνειάς της. Σε αυτό το σεμινάριο, θα μάθετε την πολικότητα του νερού και πώς δημιουργεί μερικές από τις πιο σημαντικές ιδιότητες του νερού.
Θέματα που καλύπτονται σε άλλα άρθρα
- Τι είναι ο πολικός ομοιοπολικός δεσμός;
- Πολικοί δεσμοί και μη πολικοί δεσμοί και μόρια
- Τι είναι η Ηλεκτραρνητικότητα;
- Θεωρία VSEPR
- Τι είναι η Διαλυμένη; Διαλύτης εναντίον Διαλυμένης ουσίας με Παραδείγματα
Τι σημαίνει για ένα μόριο να είναι πολικό;
Εξ ορισμού, ένα πολικό μόριο έχει μερικώς θετικό άκρο και μερικώς αρνητικό άκρο. Το μόριο το επιτυγχάνει αυτό έχοντας μια άνιση κατανομή ηλεκτρονίων μεταξύ του ατόμου του. Δηλαδή, τα ηλεκτρόνια συγκεντρώνονται πιο κοντά στο ένα άτομο από το άλλο, καθιστώντας έτσι το ένα άτομο ελαφρώς πιο αρνητικό από το άλλο. Επιπλέον, αυτά τα άτομα πρέπει επίσης να είναι διατεταγμένα με τέτοιο τρόπο ώστε τα επιμέρους φορτία τους να μην αλληλοεξουδετερώνονται.
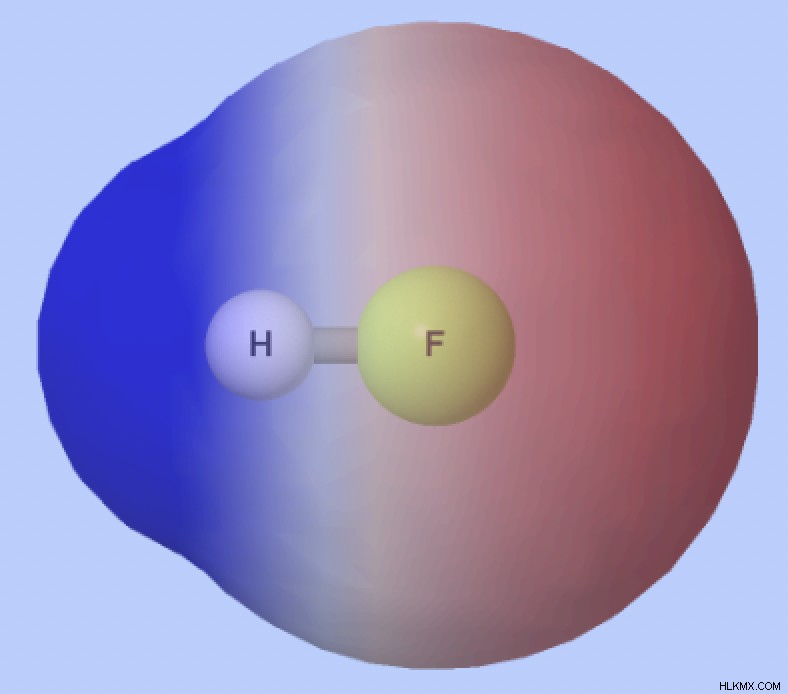
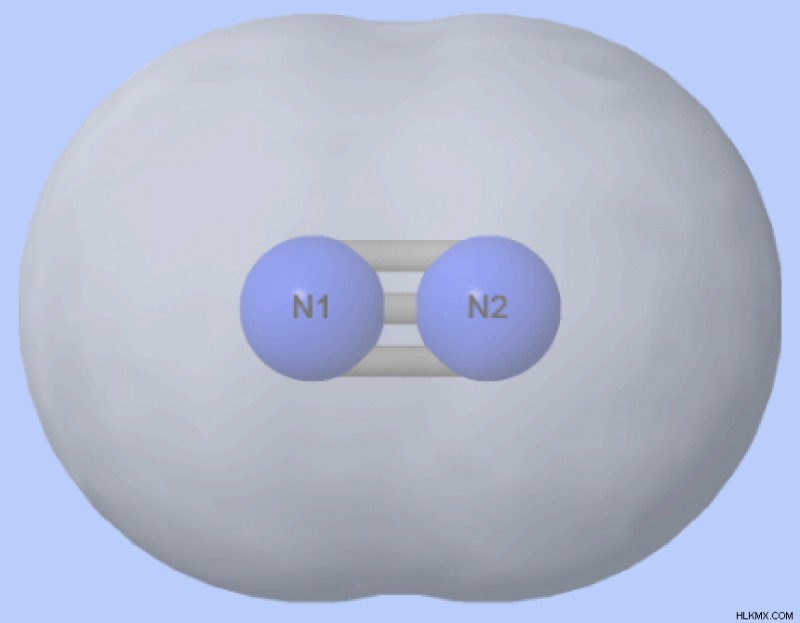
Είναι το νερό πολικό;
Όπως αναφέρθηκε παραπάνω, για να είναι πολικό, ένα μόριο πρέπει να έχει πολικούς ομοιοπολικούς δεσμούς και να είναι ασύμμετρο.
Έχει το νερό πολικούς ομοιοπολικούς δεσμούς;
Η ηλεκτραρνητικότητα του οξυγόνου είναι 3,5 και η ηλεκτραρνητικότητα του υδρογόνου είναι 2,1, με αποτέλεσμα η διαφορά στην ηλεκτραρνητικότητα μεταξύ τους να είναι 1,4. Τα άτομα σε πολικούς ομοιοπολικούς δεσμούς έχουν γενικά μια διαφορά στην ηλεκτραρνητικότητα μεταξύ 0,4 και 1,7. Έτσι, οι δεσμοί Ο–Η στα μόρια του νερού —όπου το άκρο Ο είναι μερικώς αρνητικό και το άκρο Η μερικώς θετικό— είναι πολικοί ομοιοπολικοί δεσμοί.
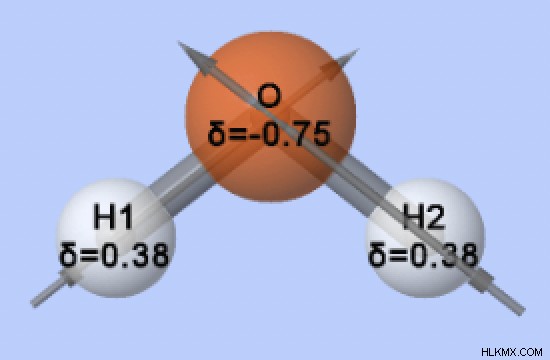
Είναι το νερό ασύμμετρο;
Το άτομο οξυγόνου σε ένα μόριο νερού συνδέεται με 2 άτομα υδρογόνου και 2 μεμονωμένα ζεύγη, δίνοντάς του τον στερικό αριθμό 4. Σύμφωνα με τη θεωρία VSEPR, ένας στερικός αριθμός 4 σημαίνει ότι η γεωμετρία ηλεκτρονίων του νερού είναι τετραεδρική. Επιπλέον, επειδή αυτός ο στερικός αριθμός περιλαμβάνει 2 μεμονωμένα ζεύγη, η μοριακή γεωμετρία του νερού κάμπτεται. Μια λυγισμένη δομή δίνει στο μόριο του νερού την ασυμμετρία του.
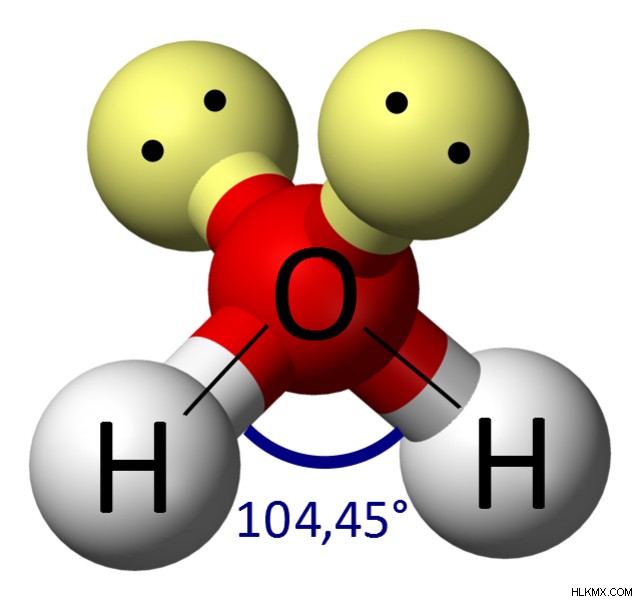
Συμπερασματικά, το νερό είναι πολικό γιατί έχει πολικούς ομοιοπολικούς δεσμούς και είναι ασύμμετρος.
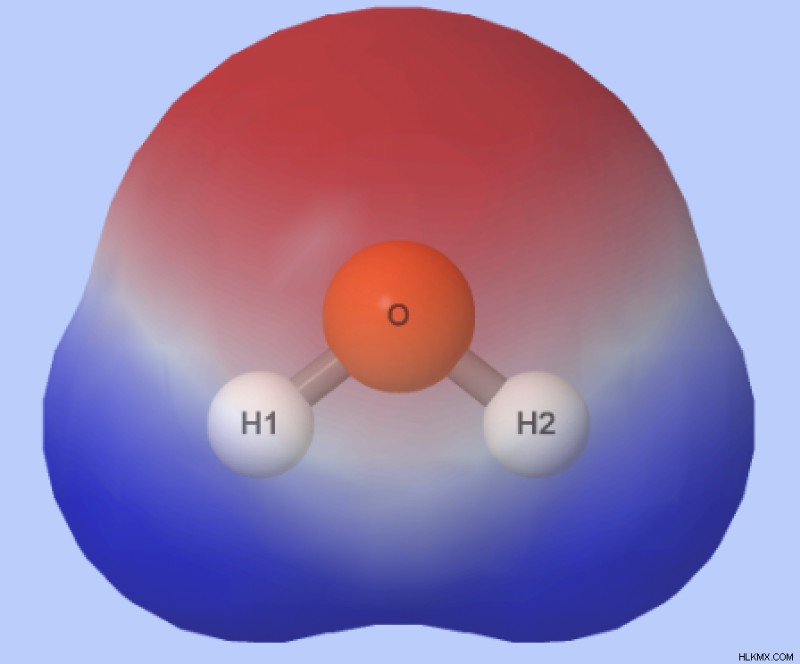
Τι προκύπτει από την πολικότητα του νερού;
Το νερό ως γενικός διαλύτης
Θυμηθείτε τον χρυσό κανόνα της διαλυτότητας:όπως διαλύεται όπως. Επομένως, το νερό, ως πολικός διαλύτης, διαλύει εύκολα πολικές διαλυμένες ουσίες. Το πώς διαλύεται έχει ως εξής:τα μερικώς θετικά άτομα υδρογόνου του νερού μανδαλώνουν στα αρνητικά φορτισμένα άτομα της διαλυμένης ουσίας, ενώ το μερικώς αρνητικό οξυγόνο του νερού έλκει τα θετικά φορτισμένα άτομα της διαλυμένης ουσίας. Με αυτόν τον τρόπο, το νερό διασπά τους ομοιοπολικούς ή ιοντικούς δεσμούς της διαλυμένης ουσίας, διαχωρίζοντας τα άτομα της διαλυμένης ουσίας το ένα από το άλλο.
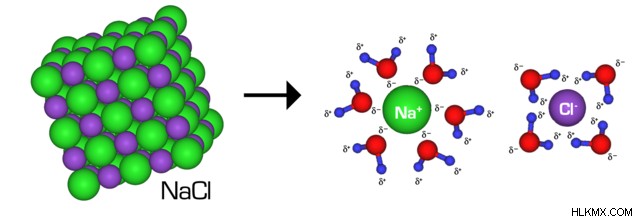
Ωστόσο, το νερό δεν μπορεί να διαλύσει μη πολικές διαλυμένες ουσίες όπως λάδι ή κερί (θυμηθείτε τον χρυσό κανόνα ), γεγονός που κάνει τον τίτλο του «καθολικού διαλύτη» λίγο παραπλανητικό.
Δεσμός υδρογόνου
Η πολικότητα του νερού του επιτρέπει να σχηματίζει δεσμούς υδρογόνου, μια ισχυρότερη εκδοχή της συνηθισμένης διαμοριακής δύναμης διπόλου-διπόλου (και ΟΧΙ ένας τύπος ομοιοπολικού ή ιοντικού δεσμού όπως μπορεί να υπονοεί το όνομά του). Ο δεσμός υδρογόνου συμβαίνει μεταξύ ενός μερικώς θετικού ατόμου Η (συνήθως συνδεδεμένο με ένα άτομο N, O ή F) ενός μορίου και ενός μερικώς αρνητικού ατόμου (συνήθως N, O ή F) ενός άλλου μορίου. Στην περίπτωση του νερού, ο δεσμός υδρογόνου συμβαίνει μεταξύ ενός ατόμου Η ενός μορίου νερού και ενός ατόμου Ο ενός άλλου μορίου νερού.
Ο δεσμός υδρογόνου δίνει συνοχή στο νερό, πρόσφυση και υψηλό σημείο βρασμού.
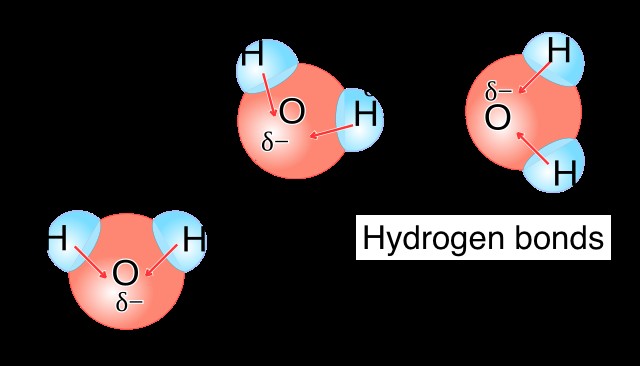
Συνοχή
Η συνοχή αναφέρεται στην έλξη μεταξύ μορίων του ίδιου τύπου. Με άλλα λόγια, στα μόρια με ισχυρές συνεκτικές δυνάμεις αρέσει να κολλάνε μεταξύ τους. Χάρη στην ικανότητά του να σχηματίζει ισχυρούς δεσμούς υδρογόνου, το νερό είναι ένα τέτοιο μόριο.

Στα μόρια του νερού αρέσει να κολλάνε μεταξύ τους, και τέτοια κολλητικότητα (δηλαδή συνεκτικές δυνάμεις) προκαλεί την επιφανειακή τάση του νερού. Η επιφανειακή τάση είναι η ικανότητα της επιφάνειας ενός υγρού να αντιστέκεται σε μια εξωτερική δύναμη συμπεριφέροντας σαν ελαστική μεμβράνη. Στην περίπτωση του νερού, η επιφανειακή του τάση επιτρέπει σε μικρά έντομα να κινούνται κατά μήκος του χωρίς να χρειάζεται να κολυμπήσουν ή να επιπλέουν, όπως ο δρομέας νερού που απεικονίζεται παρακάτω.

Συγκόλληση
Η προσκόλληση αναφέρεται στην έλξη μεταξύ μορίων διαφορετικών τύπων. Η πολικότητα του νερού του επιτρέπει να κολλήσει σε άλλα πολικά μόρια. Έτσι, όσο πιο πολικό είναι ένα μόριο, τόσο καλύτερο νερό θα κολλήσει σε αυτό.
Οι συγκολλητικές και συνεκτικές δυνάμεις του νερού επιτρέπουν στο νερό να εκτελεί τριχοειδή δράση. Κατά τη διάρκεια της τριχοειδούς δράσης, το νερό ρέει μέσα από ένα στενό χώρο χωρίς τη βοήθεια, ή ακόμη και ενάντια στη βαρύτητα. Αυτό είναι σημαντικό γιατί πολλές διαδικασίες στην καθημερινή ζωή βασίζονται στην τριχοειδική δράση. Η τριχοειδής δράση βοηθά το νερό να φτάσει στις ρίζες ορισμένων φυτών. Η τριχοειδής δράση επιτρέπει σε χαρτοπετσέτες και σφουγγάρια να απορροφούν νερό. Επιπλέον, ορισμένες επιστημονικές τεχνικές όπως η χρωματογραφία λεπτής στοιβάδας χρησιμοποιούν τριχοειδική δράση.

Περισσότερες αναγνώσεις
- Το εύχρηστο στοιχείο υδρογόνο
- Οξυγόνο:Το πιο ευέλικτο στοιχείο
- Ksp – Σταθερά προϊόντος διαλυτότητας
- Τι είναι η χρωματογραφία;
- Τι είναι η λύση στη Χημεία;