Διαφορά μεταξύ μοριακού και δομικού τύπου
Κύρια διαφορά – Μοριακός vs Δομικός τύπος
Ο μοριακός τύπος και ο δομικός τύπος των ενώσεων αντιπροσωπεύουν άτομα διαφορετικών χημικών στοιχείων που υπάρχουν στις ενώσεις. Ο μοριακός τύπος δίνει την αναλογία μεταξύ αυτών των στοιχείων. Ο δομικός τύπος δίνει τις σχετικές θέσεις αυτών των ατόμων. Η κύρια διαφορά μεταξύ του μοριακού τύπου και του συντακτικού τύπου είναι ότι ο μοριακός τύπος δεν μπορεί να υποδεικνύει τις σχετικές θέσεις των ατόμων, ενώ ο δομικός τύπος υποδεικνύει τις σχετικές θέσεις των ατόμων.
Βασικές περιοχές που καλύπτονται
1. Τι είναι Μοριακός Τύπος
– Ορισμός, εύρεση του μοριακού τύπου
2. Τι είναι η Δομική Φόρμουλα
– Ορισμός, Χρήσεις
3. Ποια είναι η διαφορά μεταξύ του μοριακού και του δομικού τύπου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Συμπυκνωμένος τύπος, Εμπειρικός τύπος, Δομή Lewis, Μοριακός τύπος, Δομικός τύπος

Τι είναι ο Μοριακός Τύπος
Ο μοριακός τύπος ή ο χημικός τύπος μιας ένωσης είναι η αναπαράσταση των τύπων ατόμων και των αναλογιών τους που υπάρχουν σε αυτήν την ένωση. Ο μοριακός τύπος δίνεται με σύμβολα χημικών στοιχείων και τους αριθμούς που αντιπροσωπεύουν την αναλογία μεταξύ τους. Αυτή η αναλογία είναι ο πραγματικός ακέραιος αριθμός των ατόμων (ο απλούστερος ακέραιος αριθμός δίνεται από τον εμπειρικό τύπο).
Ο μοριακός τύπος μπορεί να χρησιμοποιηθεί στην ονοματολογία απλών μορίων, αλλά όχι για πολύπλοκα μόρια. Ένας μοριακός τύπος μιας ένωσης μπορεί να χρησιμοποιηθεί για να προσδιοριστεί εάν η ένωση είναι μια δυαδική ένωση, τριαδική ένωση, τεταρτοταγής ένωση ή έχει ακόμη περισσότερα στοιχεία.
Ο μοριακός τύπος μιας ένωσης μπορεί να βρεθεί όταν δίνονται οι απαιτούμενες λεπτομέρειες. Τα ακόλουθα παραδείγματα δείχνουν πώς να βρείτε τον μοριακό τύπο.
Ερώτηση:
Βρείτε τον μοριακό τύπο μιας ένωσης που έχει C=40%, H=6,72% το υπόλοιπο είναι οξυγόνο και το μοριακό βάρος της ένωσης βρίσκεται 180 g/mol.
Απάντηση:
Τα στοιχεία που υπάρχουν είναι:
C =40%
H =6,72%
O =(100-{40+6,72}) % =53,28%
Ο αριθμός των γραμμομορίων κάθε στοιχείου που υπάρχει σε 100 g της ένωσης,
C =40g/12gmol-1 =3,33 mol
H =6,72g/1gmol-1 =6,72 mol
O =53,28g/16gmol-1 =3,33 mol
Η απλούστερη αναλογία μεταξύ αυτών των στοιχείων βρίσκεται διαιρώντας κάθε τιμή με τη μεγαλύτερη τιμή μεταξύ τους.
C =3,33 mol / 6,72 mol =½
H =6,72 mol / 6,72 mol =1
O =3,33 mol / 6,72 mol =½
Βρείτε την απλούστερη αναλογία ακέραιων αριθμών μεταξύ αυτών των ατόμων;
C =½ x 2 =1
H =1 x 2 =2
O =½ x 2 =1
Ως εκ τούτου, ο εμπειρικός τύπος της ένωσης είναι CH2 O.
Για να βρούμε τον μοριακό τύπο χρησιμοποιώντας αυτόν τον εμπειρικό τύπο, πρέπει πρώτα να βρούμε τον αριθμό των μονάδων εμπειρικού τύπου που υπάρχουν στην ένωση.
Μοριακή μάζα εμπειρικού τύπου μονάδα =CH2O =(12 g/mol) + (1g/mol x 2) + 16g/mol)
mol.
Ο αριθμός των μονάδων εμπειρικού τύπου που υπάρχουν στην ένωση =180 gmol-1 / 30 gmol-1 =6
Στη συνέχεια, ο μοριακός τύπος της ένωσης μπορεί να ληφθεί με πολλαπλασιάζοντας τον εμπειρικό τύπο επί 6.
Μοριακός τύπος =(CH2O) x 6 =C6H12O6
Τι είναι ο δομικός τύπος
Ο δομικός τύπος μιας ένωσης είναι η αναπαράσταση της διάταξης των ατόμων στην ένωση. Αυτός ο δομικός τύπος δίνει πολλές λεπτομέρειες σχετικά με το μόριο και οι ιδιότητες της ένωσης μπορούν επίσης να προβλεφθούν χρησιμοποιώντας αυτές τις λεπτομέρειες.
Ο δομικός τύπος μπορεί να χρησιμοποιηθεί για την ονοματολογία του μορίου. Αυτό συμβαίνει επειδή ο δομικός τύπος δείχνει όλες τις λειτουργικές ομάδες που υπάρχουν στην ένωση και τις σχετικές τους θέσεις. Ο δομικός τύπος μπορεί επίσης να χρησιμοποιηθεί για την πρόβλεψη των χημικών ιδιοτήτων της ένωσης (όπως η πολικότητα) και των φυσικών ιδιοτήτων (όπως το σημείο βρασμού).
Υπάρχουν λίγοι διαφορετικοί τρόποι που χρησιμοποιούνται για να δοθεί ο δομικός τύπος. Οι δομές Lewis δείχνουν τη συνδεσιμότητα των ατόμων και των μεμονωμένων ζευγών ή μη ζευγαρωμένων ηλεκτρονίων στην ένωση. Ο συμπυκνωμένος τύπος είναι ένας άλλος τύπος δομικού τύπου, ο οποίος δίνει τις σχετικές θέσεις των ατόμων, αλλά αυτό δεν είναι πολύ χρήσιμο (Π.χ.:CH3 CH2 Το ΟΗ είναι ο συμπυκνωμένος τύπος της αιθανόλης).
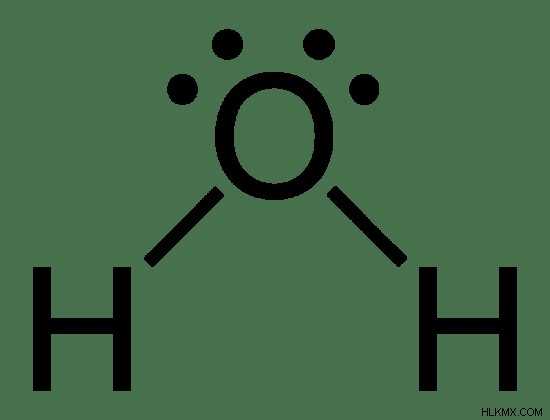
Εικόνα 1:Δομή Lewis του μορίου νερού
Ένας σημαντικός τύπος δομικού τύπου στην οργανική χημεία είναι οι σκελετικοί τύποι. Τα περισσότερα πολύπλοκα οργανικά μόρια μπορούν να δοθούν μέσω σκελετικών τύπων. Αυτός ο τύπος τύπων δείχνει τις συναρτησιακές ομάδες και τις θέσεις τους. Αλλά τα άτομα υδρογόνου που συνδέονται με τα άτομα άνθρακα δεν υποδεικνύονται εκεί.

Εικόνα 2:Σκελετικός τύπος αιθυλενογλυκόλης
Στη στερεοχημεία, υπάρχουν πολλές μορφές δομικών τύπων. Για παράδειγμα, ο δομικός τύπος υποδεικνύει τη γεωμετρία cis-trans της ένωσης, την προβολή Newman και την προβολή των οργανικών ενώσεων με πριονίδι, την προβολή Fischer των μορίων σακχάρου, την προβολή Haworth κ.λπ.
Διαφορά μεταξύ μοριακού και δομικού τύπου
Ορισμός
Μοριακός τύπος: Ο μοριακός τύπος ή ο χημικός τύπος μιας ένωσης είναι η αναπαράσταση των τύπων ατόμων και των αναλογιών τους που υπάρχουν σε αυτήν την ένωση.
Δομικός τύπος: Ο δομικός τύπος μιας ένωσης είναι η αναπαράσταση της διάταξης των ατόμων στην ένωση.
Δίνονται λεπτομέρειες
Μοριακός τύπος: Ο μοριακός τύπος δίνει την αναλογία μεταξύ των ατόμων που υπάρχουν στην ένωση.
Δομικός τύπος: Το δομικό τυπικό δίνει τη διάταξη των ατόμων και τις σχετικές θέσεις των λειτουργικών ομάδων στην ένωση.
Χρησιμοποιήσεις
Μοριακός τύπος: Ο μοριακός τύπος μπορεί να χρησιμοποιηθεί για την ονοματολογία απλών μορίων, για να προσδιοριστεί εάν η ένωση είναι μια δυαδική ένωση, τριαδική ένωση, τεταρτοταγής ένωση ή έχει ακόμη περισσότερα στοιχεία, κ.λπ.
Δομικός τύπος: Ο δομικός τύπος μπορεί να χρησιμοποιηθεί για την ονοματολογία σύνθετων μορίων και για την πρόβλεψη των χημικών ιδιοτήτων της ένωσης (όπως η πολικότητα) και των φυσικών ιδιοτήτων (όπως το σημείο βρασμού).
Συμπέρασμα
Ο μοριακός τύπος και ο συντακτικός τύπος είναι πολύ σημαντικοί για τον προσδιορισμό της πραγματικής δομής μιας ένωσης. Η κύρια διαφορά μεταξύ του μοριακού τύπου και του συντακτικού τύπου είναι ότι ο μοριακός τύπος δεν μπορεί να υποδεικνύει τις σχετικές θέσεις των ατόμων, ενώ ο δομικός τύπος υποδεικνύει τις σχετικές θέσεις των ατόμων.
Αναφορά:
1. Helmenstine, Anne Marie. "Υπολογισμός σύνθετου εμπειρικού &μοριακού τύπου." ThoughtCo, 4 Αυγούστου 2017, Διαθέσιμο εδώ.
2. "2.1:Δομικοί τύποι." Chemistry LibreTexts, Libretexts, 22 Ιουνίου 2017, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. "Water-2D-flat" (Δημόσιος Τομέας) μέσω Commons Wikimedia
2. «Αιθυλενογλυκόλη» Του Sander de Jong – Ίδιο έργο (Δημόσιος Τομέας) μέσω Commons Wikimedia




