Πώς να εξισορροπήσετε μια χημική εξίσωση;
Για να εξισορροπήσετε μια χημική εξίσωση, ξεκινήστε μετρώντας τον αριθμό των ατόμων κάθε στοιχείου και στις δύο πλευρές του βέλους. Στη συνέχεια, εξισορροπήστε τα πρωτεύοντα στοιχεία (αφήνοντας το υδρογόνο και το οξυγόνο για το τέλος) πολλαπλασιάζοντάς τα με κατάλληλους αριθμούς και, τέλος, ισορροπήστε το υδρογόνο και το οξυγόνο με τον ίδιο τρόπο.
Πώς θα ήταν η γεύση του φαγητού σας εάν τα συστατικά δεν προστέθηκαν στις σωστές αναλογίες;
Κακό? Ίσως εντελώς μη βρώσιμο;
Παρόμοια με τα τρόφιμα, τα συστατικά μιας χημικής αντίδρασης (αντιδρώντα) πρέπει να υπάρχουν στις σωστές αναλογίες για να σχηματιστούν τα επιθυμητά προϊόντα.
Επίσης, ο νόμος της διατήρησης της μάζας δηλώνει ότι η μάζα δεν μπορεί ούτε να δημιουργηθεί ούτε να καταστραφεί, αλλά μπορεί μόνο να αναδιαταχθεί. Αυτό ακριβώς συμβαίνει σε μια χημική αντίδραση. Τα άτομα των αντιδραστηρίων αναδιατάσσονται για να παράγουν προϊόντα και η ποσότητα (ο αριθμός των ατόμων) κάθε στοιχείου δεν αλλάζει όταν υφίσταται αυτήν την αναδιάταξη (αντίδραση).
Έτσι, όταν γράφουμε μια χημική εξίσωση για μια αντίδραση, είναι υψίστης σημασίας να διασφαλίζουμε ότι τηρείται ο νόμος και ότι ο αριθμός των ατόμων κάθε στοιχείου είναι ίσος και στις δύο πλευρές της εξίσωσης. Εάν επιτευχθεί αυτό, η αντίδραση λέγεται ότι είναι ισορροπημένη.

Ακριβώς όπως ο Thanos, ο νόμος της διατήρησης της μάζας απαιτεί κάθε χημική εξίσωση να είναι τέλεια ισορροπημένη.
Τι είναι μια χημική εξίσωση;
Πριν προχωρήσουμε στη διαδικασία, ας αναλύσουμε μια χημική εξίσωση και ας εξοικειωθούμε λίγο με τα διάφορα συστατικά της. Οι χημικές εξισώσεις είναι προσεκτικά συσκευασμένες και παρουσιάζονται διατάξεις χημικών συμβόλων και αριθμών για να περιγράψουν μια χημική αντίδραση.
Μια χημική εξίσωση μπορεί να ομαδοποιηθεί σε δύο μέρη:το μισό του αντιδρώντος και το μισό προϊόν. Το ήμισυ του αντιδρώντος είναι αυτό στην αριστερή πλευρά του βέλους με τα χημικά σύμβολα κάθε συμμετέχοντος αντιδρώντος, ενώ τα προϊόντα που προκύπτουν από την αντίδραση των αντιδρώντων αναγράφονται στη δεξιά πλευρά του βέλους.
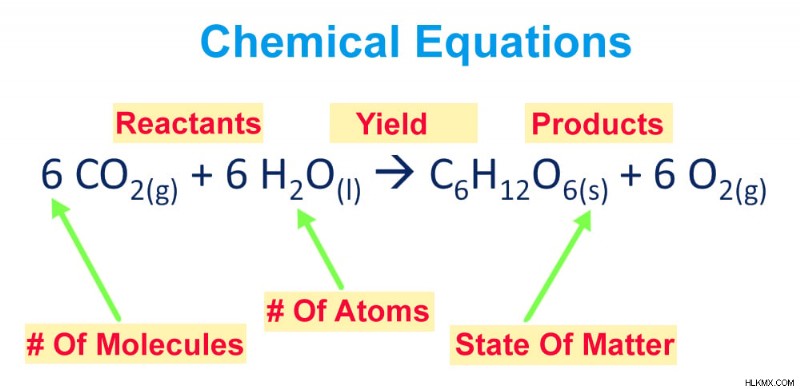
Συστατικά μιας χημικής εξίσωσης
Επιπλέον, η φυσική κατάσταση κάθε στοιχείου σημειώνεται επίσης μετά από τα χημικά σύμβολα/τους τύπους τους σε μορφή δείκτη. Μιλώντας για δείκτες, οι αριθμοί που γράφονται σε δείκτες μετά από ένα χημικό σύμβολο υποδεικνύουν τον αριθμό των ατόμων του στοιχείου που υπάρχουν.
Οι συντελεστές που τοποθετούνται πριν από κάθε χημικό σύμβολο προκύπτουν από την πράξη εξισορρόπησης της εξίσωσης και μεταφέρουν πληροφορίες σχετικά με τον αριθμό των μορίων κάθε στοιχείου/ένωσης.
Πώς να εξισορροπήσετε μια χημική εξίσωση;
Η εξισορρόπηση μιας εξίσωσης απέχει πολύ από τη χειρουργική επέμβαση στον εγκέφαλο. Το μόνο που χρειάζεται είναι να έχεις λίγο ταλέντο με τους αριθμούς και την ικανότητα να ακολουθείς βασικά βήματα. Η διαδικασία ξεκινά με μια επιθεώρηση της εξίσωσης αντίδρασης. Τα άτομα κάθε στοιχείου σε κάθε πλευρά του βέλους μετρώνται. Εάν δεν είναι ίδια, εκτελούνται τα ακόλουθα βήματα για να εξισορροπηθούν.
Βήμα 1:Σημειώστε τον αριθμό των ατόμων κάθε στοιχείου
Όπως αναφέρθηκε, ξεκινήστε μετρώντας και σημειώνοντας τον αριθμό των ατόμων κάθε στοιχείου και στις δύο πλευρές της αντίδρασης. Ας εξετάσουμε την αντίδραση του ατμοσφαιρικού αζώτου με το υδρογόνο. Τα δύο αντιδρούν για να δώσουν αμμωνία (NH3) και η αντίδραση ονομάζεται «Η διαδικασία Haber-Bosch». Η μη ισορροπημένη εξίσωση για αυτήν την αντίδραση είναι:
N2 + H2 → NH3
Η επιθεώρηση αποκαλύπτει ότι η εξίσωση έχει 2 άτομα αζώτου που συνδυάζονται με 2 άτομα υδρογόνου για να παράγουν ένα μόνο μόριο αμμωνίας. Ωστόσο, η αμμωνία έχει 3 άτομα υδρογόνου, ενώ η πλευρά του αντιδρώντος έχει μόνο 2. Επίσης, η πλευρά του αντιδραστηρίου έχει 1 άτομο αζώτου περισσότερο από την πλευρά του προϊόντος. Σαφώς, η εξίσωση δεν είναι ισορροπημένη και δεν υπακούει στο νόμο της διατήρησης της μάζας. Ο Thanos δεν θα το ενέκρινε αυτό, οπότε ας εξισορροπήσουμε την εξίσωση προτού κουμπώσει!

Βήμα 2:Ξεκινήστε με το πρωτεύον στοιχείο
Όταν εξισορροπείτε μια χημική εξίσωση, αφήνετε πάντα τα άτομα υδρογόνου και οξυγόνου για το τέλος (καθώς συχνά υπάρχουν και στις δύο πλευρές). Ξεκινήστε με ένα στοιχείο που εμφανίζεται μόνο σε ένα από τα αντιδρώντα και ένα από τα προϊόντα.
Στο παράδειγμά μας, το μόνο στοιχείο εκτός από το υδρογόνο είναι το άζωτο, οπότε ας το εξισορροπήσουμε. Η πλευρά του αντιδραστηρίου έχει 2 άτομα αζώτου, ενώ η πλευρά του προϊόντος έχει ένα μόνο άτομο. Απλώς πολλαπλασιάζοντας την αμμωνία επί 2 θα εξισορροπούσε τον αριθμό των ατόμων αζώτου. Η εξίσωση είναι τώρα:
N2 + H2 → 2NH3
Τώρα έχουμε 2 άτομα αζώτου και στις δύο πλευρές, οπότε το άζωτο είναι ισορροπημένο. Ας περάσουμε στο υδρογόνο στη συνέχεια.
Ας ενημερώσουμε επίσης το τραπεζάκι μας.

Βήμα 3:Ισορροπήστε τα άτομα υδρογόνου και οξυγόνου
Στο τελικό βήμα, ισορροπούμε τα άτομα υδρογόνου και οξυγόνου. Σύμφωνα με τον πίνακά μας, ο αριθμός των ατόμων υδρογόνου έχει αυξηθεί σε 6, ενώ η πλευρά του αντιδρώντος έχει ακόμα μόνο 2 άτομα υδρογόνου. Πώς μπορούμε να μετατρέψουμε το 2 σε 6; Πολλαπλασιάζοντάς το με 3. Ας το κάνουμε λοιπόν!
N2 + 3H2 → 2NH3
Τώρα έχουμε 6 άτομα υδρογόνου και στις δύο πλευρές. Έτσι, το υδρογόνο είναι επίσης ισορροπημένο. Ο πίνακας τώρα γράφει:

Ας κάνουμε έναν τελικό έλεγχο για να διασφαλίσουμε ότι όλα τα στοιχεία είναι ισορροπημένα. Ο αριθμός των ατόμων αζώτου και στις δύο πλευρές είναι ίδιος, όπως και ο αριθμός των ατόμων υδρογόνου. Έτσι, η χημική μας εξίσωση είναι τέλεια ισορροπημένη (όπως θα έπρεπε να είναι όλα τα πράγματα).
Ένα άλλο παράδειγμα ισορροπημένης χημικής εξίσωσης
Ας εξετάσουμε μια άλλη χημική αντίδραση και ας προσπαθήσουμε να την εξισορροπήσουμε. Μετά από όλα, η πρακτική κάνει τέλειο. Τι θα λέγατε για την αντίδραση φωτοσύνθεσης; Στην αντίδραση, το διοξείδιο του άνθρακα και το νερό αντιδρούν μεταξύ τους για να παράγουν γλυκόζη (C6H12O6) και το τόσο απαραίτητο οξυγόνο. Η μη ισορροπημένη εξίσωση είναι:
CO2 + H2O → C6H12O6 + O2

Αφήνοντας το υδρογόνο και το οξυγόνο για αργότερα, ας εξισορροπήσουμε τον αριθμό των ατόμων άνθρακα και στις δύο πλευρές. Η πλευρά του αντιδρώντος έχει μόνο 1 άτομο άνθρακα, ενώ το προϊόν γλυκόζης έχει 6 άνθρακες. Ο πολλαπλασιασμός του CO2 επί 6 θα πρέπει να εξισορροπήσει τα άτομα άνθρακα για εμάς. Έτσι:
6CO2 + H20 → C6H12O6 + O2

Τώρα, ας περάσουμε στο υδρογόνο. Σύμφωνα με τον πίνακα, έχουμε 2 άτομα υδρογόνου στην πλευρά του αντιδρώντος και 12 από αυτά στην άλλη πλευρά του βέλους. Ο πολλαπλασιασμός του H2O επί 6 θα εξισορροπήσει το υδρογόνο για εμάς.
6CO2 + 6H2O → C6H12O6 + O2

Το μόνο στοιχείο που μένει να ισορροπήσει είναι το οξυγόνο. Η πλευρά του αντιδραστηρίου έχει 18 από αυτά, ενώ η πλευρά του προϊόντος έχει μόνο 8. Αν πολλαπλασιάσουμε τη γλυκόζη με οποιονδήποτε αριθμό, τα υπόλοιπα στοιχεία θα γίνουν ανισόρροπα, οπότε ας εστιάσουμε στο σόλο μόριο του οξυγόνου αντ' αυτού
Ο πολλαπλασιασμός του επί 6 έχει ως αποτέλεσμα συνολικά 12 άτομα. Όταν αυτά προστεθούν στα ήδη υπάρχοντα 6 άτομα οξυγόνου στη γλυκόζη, η εξίσωση εξισορροπείται.
6CO2 + 6H2O → C6H12O6 + 6O2

Σύμφωνα με τον πίνακα, όλα τα στοιχεία βρίσκονται τώρα σε ίσες ποσότητες στις απέναντι πλευρές του βέλους. Έτσι, η εξίσωσή μας είναι ισορροπημένη.
Τελικές λέξεις
Εκτός από τη μέθοδο (μέθοδος επιθεώρησης) που μόλις μάθαμε, υπάρχουν άλλες δύο μέθοδοι για την εξισορρόπηση μιας χημικής εξίσωσης. Το πρώτο απαιτεί γνώση των αλγεβρικών εξισώσεων και τον τρόπο επίλυσής τους, ενώ το άλλο ακολουθεί μια ακόμη πιο περίπλοκη διαδρομή χρησιμοποιώντας πίνακες. Ωστόσο, η μέθοδος επιθεώρησης είναι η πιο εύκολη από τις τρεις και μπορεί να εφαρμοστεί για την εξισορρόπηση όλων των ειδών των εξισώσεων.
Μερικές σημειώσεις που πρέπει να θυμάστε κατά την εκτέλεση αυτής της μεθόδου περιλαμβάνουν:Μην εξισορροπείτε την εξίσωση αλλάζοντας τους δείκτες, αφήστε τα άτομα υδρογόνου και οξυγόνου για το τέλος, ξεκινήστε με το στοιχείο που εμφανίζεται μόνο σε ένα αντιδρόν και ένα προϊόν και εξισορροπήστε μεμονωμένα/μεμονωμένα μόρια στο τέλος.
Η εξισορρόπηση μιας χημικής εξίσωσης είναι το πρώτο βήμα στον υπολογισμό πολλών χημικών ιδιοτήτων. Αυτή η λίστα περιλαμβάνει την εύρεση του περιοριστικού αντιδραστηρίου σε μια αντίδραση και τον υπολογισμό της απόδοσης προϊόντος, μεταξύ πολλών άλλων!




