Οι κανόνες διαλυτότητας

Υπάρχουν τρία διαφορετικά αποτελέσματα που μπορούν να προκύψουν όταν συνδυάζονται διαλυμένες ουσίες και διαλύματα, μπορεί να υπάρχει ένα αραιό διάλυμα, ένα κορεσμένο διάλυμα ή ένα ίζημα. Οι κανόνες διαλυτότητας είναι γενικές οδηγίες για τη διαλυτότητα των χημικών ουσιών που θα σας βοηθήσουν να προβλέψετε το πιθανό αποτέλεσμα της ανάμειξης ενός ιοντικού στερεού με έναν διαλύτη.
Τι είναι η διαλυτότητα;
Η χημική ιδιότητα της διαλυτότητας αναφέρεται στην ικανότητα μιας συγκεκριμένης ουσίας να διαλύεται μέσα σε έναν διαλύτη. Οι διαλύτες μετρώνται με βάση την αναλογία διαλύτη προς διαλυμένη ουσία σε ισορροπία, ή με άλλα λόγια πόση διαλυμένη ουσία υπάρχει σε έναν διαλύτη σε κατάσταση ισορροπίας. Αυτό που προκύπτει από τη διάλυση μιας διαλυμένης ουσίας σε διαλύτη είναι κάτι που είναι γνωστό ως κορεσμένο διάλυμα.
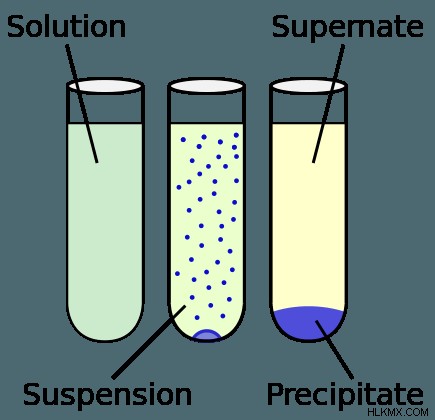
Ορισμένες ουσίες, όπως η αιθανόλη και το νερό είναι διαλυτές σε κάθε δυνατή αναλογία όταν συνδυάζονται με τον κατάλληλο διαλύτη. Το να είναι διαλυτό σε όλες τις αναλογίες είναι γνωστό ως αναμίξιμο. Εάν ξεπεραστεί η διαλυτότητα ισορροπίας ενός διαλύματος, κάτι που μπορεί να συμβεί σε ορισμένες συνθήκες, το διάλυμα λέγεται ότι είναι υπερκορεσμένο και είναι μετασταθερό στη φύση του. Η μετα-σταθερότητα αναφέρεται σε μια κατάσταση σε ένα χημικό/δυναμικό σύστημα που είναι σταθερή, εκτός της κατάστασης της ελάχιστης ενέργειας ή της βασικής κατάστασης.
Χρειάζονται ορισμένες συνθήκες για να γίνει ένα διάλυμα υπερκορεσμένο, όπως το διάλυμα στη σωστή θερμοκρασία. Καθώς το χημικό σύστημα γίνεται θερμότερο, τείνει να γίνεται πιο διαλυτό, και ως αποτέλεσμα είναι ικανό να διαλύει περισσότερη διαλυμένη ουσία σε αυτό από ότι θα μπορούσε σε χαμηλότερες θερμοκρασίες. Οι διάφορες καταστάσεις της ύλης αντιδρούν διαφορετικά στις αλλαγές θερμοκρασίας.
Παράγοντες που επηρεάζουν τη διαλυτότητα
Ενώ στις περισσότερες στερεές ουσίες αυξάνεται η διαλυτότητά τους καθώς αυξάνεται η θερμοκρασία, αυτό δεν ισχύει παγκοσμίως. Όταν το υγρό νερό βρίσκεται σε εξαιρετικά υψηλές θερμοκρασίες, θερμοκρασίες που πλησιάζουν την κρίσιμη θερμοκρασία, οι ιοντικές διαλυμένες ουσίες γίνονται λιγότερο διαλυτές λόγω των μεταβαλλόμενων ιδιοτήτων του νερού σε υψηλές θερμοκρασίες. Όταν οι διαλυμένες ουσίες είναι σε αέρια μορφή, είναι δύσκολο να προβλεφθούν οι αλληλεπιδράσεις με τις αυξήσεις της θερμοκρασίας. Γενικά, ωστόσο, τα αέρια γίνονται πιο διαλυτά όταν συνδυάζονται με οργανικούς διαλύτες σε υψηλότερες θερμοκρασίες, ενώ γίνονται λιγότερο διαλυτά στο νερό καθώς αυξάνεται η θερμοκρασία.
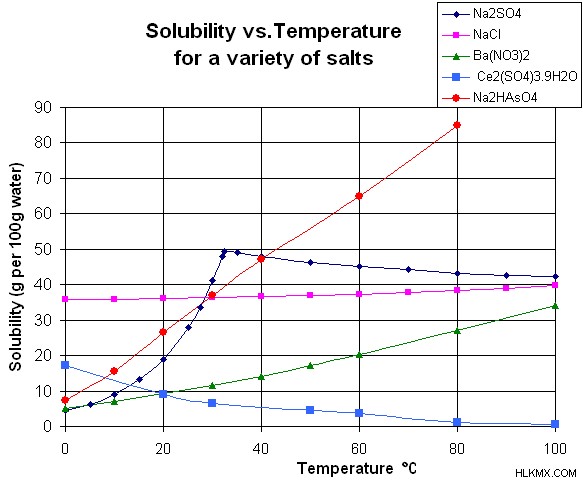
Ένας άλλος παράγοντας που επηρεάζει τη διαλυτότητα μιας ουσίας είναι η πίεση. Η επίδραση της πίεσης στη διαλυτότητα δεν είναι τόσο μεγάλη όσο η θερμοκρασία, και επομένως συχνά αντιμετωπίζεται ως ασήμαντη. Ωστόσο, είναι σημαντικό να λαμβάνεται υπόψη όταν ασχολούμαστε με ουσίες όπως το θειικό ασβέστιο, το οποίο βλέπει τη διαλυτότητά του να μειώνεται αισθητά καθώς μειώνεται η πίεση.
Οι διαλύτες είναι συνήθως στερεά ή υγρά, αν και όχι πάντα. Ο διαλύτης μπορεί να είναι είτε μείγμα είτε καθαρή ουσία. Το σύστημα στο οποίο διαλύεται ο διαλύτης, η διαλυμένη ουσία, μπορεί να είναι στερεό, υγρό ή αέριο. Εάν μια χημική ουσία δεν είναι διαλυτή, αναφέρεται ως αδιάλυτη. Αυτός ο όρος χρησιμοποιείται επίσης μερικές φορές σε ενώσεις που δεν είναι εύκολα διαλυτές. Υπάρχουν πολύ λίγες ενώσεις που δεν είναι καθόλου διαλυτές.
Διάλυση
Εάν η διαλυτότητα αναφέρεται στην ικανότητα των ουσιών να διαλύονται μέσα στη διαλυμένη ουσία, τότε η πραγματική διαδικασία της διάλυσης σε έναν διαλύτη ονομάζεται διάλυση. Η διάλυση είναι συνήθως αρκετά απλή όταν πρόκειται για ομοιοπολικές χημικές ουσίες. Οι ομοιοπολικές χημικές ουσίες όπως η αιθανόλη δημιουργούν νέους δεσμούς υδρογόνου όταν διαλύονται στο νερό. Αντίθετα, η διάλυση των ιοντικών ενώσεων μπορεί να είναι πιο περίπλοκη. Το χλωριούχο νάτριο και άλλες ιοντικές ενώσεις διαλύονται σε ξεχωριστά ιόντα όταν συνδυάζονται με νερό. Αυτά τα ξεχωριστά ιόντα ουσιαστικά απλώς αποκτούν ένα κάλυμμα μορίων νερού, που τυλίγονται σε αυτά. Παρά το γεγονός ότι τα ιόντα χλωριούχου νατρίου δεν διαλύονται όπως διαλύεται η αιθανόλη, το χλωριούχο νάτριο εξακολουθεί να θεωρείται υδατοδιαλυτό, επειδή όταν ο διαλύτης εξατμίζεται, ως αποτέλεσμα παραμένει κρυσταλλικό χλωριούχο νάτριο.

Κατά τον προσδιορισμό του πόσο πιθανό είναι μια ουσία να είναι διαλυτή σε μια άλλη ουσία, μπορεί να χρησιμοποιηθεί το ευρετικό «όπως διαλύεται όπως». Αυτό αναφέρεται στον γενικό κανόνα ότι οι διαλύτες που έχουν παρόμοιες χημικές δομές με τις διαλυμένες ουσίες με τις οποίες συνδυάζονται διαλύουν τις εν λόγω διαλυμένες ουσίες καλύτερα. Λάβετε υπόψη ότι αυτό είναι απλώς μια ευρετική και ότι υπάρχουν εξαιρέσεις σε αυτόν τον κανόνα.
Όσον αφορά τη μέτρηση της διαλυτότητας, η διαλυτότητα μιας ουσίας δίνεται συχνά ως συγκέντρωση. Η μορφή είναι X ποσότητα διαλυμένης ουσίας ανά κιλά διαλύτη ή X ανά 100 mL διαλύτη.
Το νερό διαλύει ορισμένα στερεά
Η σακχαρόζη είναι η ζάχαρη που χρησιμοποιούμε για να γλυκάνουμε ποτά όπως το τσάι και ο καφές. Ο άνθρακας, το υδρογόνο και το οξυγόνο στη σακχαρόζη συνδέονται μεταξύ τους με διαμοριακές δυνάμεις, αλλά αυτές οι δυνάμεις είναι αρκετά αδύναμες. Όταν η ζάχαρη τοποθετείται στο νερό, οι δεσμοί που συγκρατούν τα μόρια μαζί διαλύονται εύκολα, διαλύοντας τη ζάχαρη στο νερό. Αυτό σημαίνει ότι αυτά τα μόρια C12H22O11 καταλήγουν να απελευθερώνονται στο διάλυμα.
Απαιτείται ενέργεια για τη διάσπαση των δεσμών μεταξύ των μορίων εντός της σακχαρόζης και επίσης απαιτείται ενέργεια για τη διάσπαση των δεσμών οξυγόνου-υδρογόνου στο νερό. Προκειμένου τα μόρια σακχαρόζης να εμπλέκονται στο διάλυμα, πρέπει να διαταραχθούν οι δεσμοί υδρογόνου στο νερό. Υπάρχουν ασθενείς δεσμοί που σχηματίζονται μεταξύ του διαλύτη και της διαλυμένης ουσίας, και αυτοί μπορούν να αναπληρώσουν την ενέργεια που απαιτείται για να διαταραχθεί η δομή του διαλύτη και της διαλυμένης ουσίας. Η ζάχαρη και το νερό αναμειγνύονται τόσο καλά που ένα λίτρο νερού μπορεί να διαλύσει 1800 g σακχαρόζης.
Τα άλατα, ιοντικά στερεά, μπορεί να περιέχουν αρνητικά και θετικά ιόντα. Αυτά τα ιόντα συνδέονται μεταξύ τους με την έλξη μεταξύ σωματιδίων που έχουν αντίθετα φορτία. Τα ιόντα απελευθερώνονται στο διάλυμα καθώς τα στερεά διαλύονται στο νερό. Ως αποτέλεσμα, τα ιόντα συνδέονται με μόρια πολικών διαλυτών. Γενικά, τα άλατα διασπώνται όταν διαλύονται στο νερό, διασπώνται στα ιόντα τους. Οι ιοντικές ενώσεις είναι ικανές να διαλύονται στο νερό και η αλληλεπίδραση των ιόντων και των μορίων του νερού παράγει αρκετή ενέργεια για να αντισταθμίσει την ενέργεια που απαιτείται για τη διάσπαση των ιοντικών δεσμών του άλατος. Επιπλέον, η ενέργεια που απαιτείται για τη διάσπαση των μορίων του νερού (έτσι ώστε τα ιόντα άλατος να μπορούν να εισαχθούν στο διάλυμα) πρέπει επίσης να αντισταθμιστεί.
Ισορροπία και διαλυτότητα
Μια χημική αντίδραση βρίσκεται σε ισορροπία όταν δεν υπάρχει αλλαγή στις συγκεντρώσεις των ιόντων με την πάροδο του χρόνου. Όταν ένα σύστημα φτάσει στο σημείο ισορροπίας, το διάλυμα αναφέρεται ως κορεσμένο διάλυμα. Ονομάζεται κορεσμένο διάλυμα επειδή το διάλυμα έχει τη μέγιστη ποσότητα ιόντων που μπορεί να συνυπάρχει με τη διαλυμένη ουσία σε ισορροπία. Η ποσότητα της διαλυμένης ουσίας που πρέπει να προστεθεί σε μια δεδομένη ποσότητα διαλύματος προκειμένου το διάλυμα να κορεσθεί και να φτάσει στην ισορροπία αναφέρεται ως διαλυτότητα.
Οι κανόνες διαλυτότητας
Υπάρχουν τρία διαφορετικά αποτελέσματα που μπορούν να προκύψουν όταν συνδυάζονται διαλυμένες ουσίες και διαλύματα. Όταν η διαλυτότητα μιας διαλυμένης ουσίας και η ποσότητα της διαλυμένης ουσίας είναι ακριβώς ίσες, το αποτέλεσμα είναι ένα κορεσμένο διάλυμα. Ωστόσο, εάν υπάρχει λιγότερη διαλυμένη ουσία από την ποσότητα που μπορεί να διαλυθεί (η διαλυτότητα της χημικής ουσίας) θεωρείται αραιό διάλυμα. Τέλος, σχηματίζεται ένα ίζημα όταν κρυσταλλώνεται περίσσεια διαλυμένης ουσίας. Αυτό συμβαίνει όταν υπάρχει περισσότερη διαλυμένη ουσία από αυτή που μπορεί να αναλυθεί, με αποτέλεσμα η υπόλοιπη διαλυμένη ουσία να διαχωρίζεται από το υπόλοιπο διάλυμα.
Οι κανόνες διαλυτότητας είναι οδηγίες για τη διαλυτότητα των στερεών που βρίσκονται πιο συχνά.
Κανόνας 1:Τα διάφορα άλατα που αποτελούνται από ιόντα στοιχείων της ομάδας Ι όπως το λίθιο, το κάλιο, το νάτριο, το καίσιο και το ρουβίδιο είναι γενικά διαλυτά με λίγες εξαιρέσεις. Επίσης διαλυτά είναι άλατα που περιέχουν ιόντα αμμωνίου.
Κανόνας 2:Τα άλατα που έχουν νιτρικά ιόντα μέσα τους είναι γενικά διαλυτά.
Κανόνας 3:Τα άλατα που περιέχουν ανιόντα χλωρίου, βρωμίου ή ιωδίου είναι γενικά διαλυτά. Εξαιρέσεις σε αυτόν τον κανόνα περιλαμβάνουν άλατα αλογονιδίου, όπως αυτά που παράγονται από Ag+, Pb2+ και (Hg2)2+.
Κανόνας 4:Τα άλατα αργύρου είναι γενικά αδιάλυτα. Σημαντικές εξαιρέσεις σε αυτόν τον κανόνα περιλαμβάνουν τα Ag(C2H3O2) και AgNO3.
Κανόνας 5:Τα θειικά άλατα είναι διαλυτά, με λίγες εξαιρέσεις όπως BaSo4, PbSO4, CaSO4, SrSo4 και Ag2SO4.
Κανόνας 6:Τα άλατα υδροξειδίου τείνουν να είναι μόνο κάπως διαλυτά, εμφανίζοντας διαφορετικά επίπεδα διαλυτότητας ανάλογα με την ομάδα των στοιχείων που τα αποτελούν. Τα άλατα υδροξειδίου της ομάδας 1 είναι διαλυτά, ενώ τα άλατα υδροξειδίου της ομάδας 2 είναι ελάχιστα διαλυτά. Τα άλατα υδροξειδίου μετάλλων μεταπτώσεως, καθώς και το άλας υδροξειδίου του Al3+, είναι αδιάλυτα.
Κανόνας 7:Τα σουλφίδια που παράγονται από μέταλλα μεταπτώσεως είναι αδιάλυτα, συμπεριλαμβανομένων των Ag2S, ZnS, CdS και FeS. Τα σουλφίδια του μολύβδου, το αρσενικό, το αντιμόνιο και το βισμούθιο, έχουν επίσης αδιάλυτες φύσεις.
Κανόνας 8:Τα ανθρακικά είναι συνήθως αδιάλυτα, συμπεριλαμβανομένων των ανθρακικών της ομάδας 2 όπως BaCO3, SrCo3 και CaCo3. Το PbCO3 και το FeCO3 είναι επίσης αδιάλυτα.
Κανόνας 9:Τα χρωμικά, ανιόντα που αποτελούνται από οξυγόνο και χρώμιο, όπως το PbCrO4 και το BaCrO4, είναι συνήθως αδιάλυτα.
Κανόνας 10:Τα φωσφορικά άλατα, όπως το Ag3PO4 και το Ca3(PO4)2, είναι συνήθως αδιάλυτα.
Κανόνας 11:Τα φλουρίδια είναι συνήθως αδιάλυτα, όπως φαίνεται από ουσίες όπως PbF2, MgF2 και BaF2.




