Τρόπος Υπολογισμού Μοριακότητας &Μοριακού Τύπου
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε τον φόρμουλα μοριακότητας , και πώς να υπολογίσετε τη μοριακότητα μιας λύσης χρησιμοποιώντας την εξίσωση μοριακότητας. Εάν σας αρέσει αυτό το άρθρο, φροντίστε να ελέγξετε άλλους πόρους που συνδέονται παρακάτω!
Θέματα που καλύπτονται σε άλλα άρθρα
- Υπολογισμός μοριακής μάζας
- Μείγματα έναντι ενώσεων
- Μόριο έναντι ένωσης
- Τι είναι ο τυφλοπόντικας;
Λεξιλόγιο
- Μοριακότητα (Μ): αλλιώς γνωστή ως η μοριακή συγκέντρωση ενός διαλύματος, η μοριακότητα είναι τα mol της διαλυμένης ουσίας ανά λίτρα διαλύματος. Η μοριακότητα μπορεί να εκφραστεί ως συντομογραφίες mol/L, ή πιο δημοφιλή, M.
- Μοριακή μάζα: το άθροισμα των ατομικών βαρών που συνθέτουν ένα μόριο. Για ένα στοιχείο, είναι η ίδια τιμή με το ατομικό βάρος που εμφανίζεται στον περιοδικό πίνακα.
- Διάλυση: την ουσία σε διάλυμα που διαλύεται από τον διαλύτη. Είναι πάντα το μικρότερο συστατικό στο διάλυμα. Στη χημεία, η διαλυμένη ουσία είναι το στοιχείο ή το μόριο στο διάλυμα.
- Διαλύτης: η ουσία που διαλύει τη διαλυμένη ουσία. Αυτό είναι που αποτελεί την πλειοψηφία του διαλύματος, που είναι συνήθως νερό ή σε ορισμένες περιπτώσεις, οργανικός διαλύτης.
Τι είναι η μοριακότητα;
Μοριακότητα είναι ο αριθμός γραμμομορίων διαλυμένης ουσίας ανά λίτρο διαλύματος. Για παράδειγμα, εάν διαλύσετε επιτραπέζιο αλάτι στο νερό, το αλάτι είναι η διαλυμένη ουσία και το νερό είναι το διάλυμα. Ένα mole χλωριούχου νατρίου ζυγίζει 58,44 γραμμάρια. Εάν διαλύσετε 58,44 γραμμάρια NaCl σε ένα λίτρο νερό, έχετε ένα γραμμομοριακό διάλυμα, που συντομεύεται ως 1Μ. Είναι σημαντικό να γνωρίζετε ότι ο όγκος του διαλύματος μετράται μετά η διαλυμένη ουσία διαλύεται, όχι πριν. Επίσης, μην συγχέετε τη μοριακότητα με τη μοριακότητα , το οποίο είναι ελαφρώς διαφορετικό!
Όταν βλέπετε το "1M", το διαβάζετε δυνατά ως "1 μοριακό διάλυμα".
Τύπος μοριακότητας
Ο τύπος για τη μοριακότητα, η εξίσωση μοριακότητας, είναι M =n /v
M =μοριακή συγκέντρωση του διαλύματος, γνωστή και ως μοριακότητα
n =mole διαλυμένης ουσίας
v =λίτρα διαλύματος
Πώς υπολογίζετε τη μοριακότητα;
Η μοριακότητα υπολογίζεται, χρησιμοποιώντας τον παραπάνω τύπο γραμμομοριακότητος, λαμβάνοντας υπόψη δύο συνιστώσες:όγκο και γραμμομόρια. Στην περίπτωση που τα mol της ένωσης είναι άγνωστα, η μοριακή μάζα μπορεί να χρησιμοποιηθεί για τη μετατροπή της ένωσης από γραμμάρια σε γραμμομόρια. Ο περιοδικός πίνακας παρέχει τις ατομικές μάζες που χρησιμοποιούνται για τον υπολογισμό της μοριακής μάζας.

Βήμα 1:
Το πρώτο βήμα για τον υπολογισμό της μοριακότητας είναι ο εντοπισμός ενός από τους δύο βασικούς παράγοντες που συνθέτουν το διάλυμα:τον όγκο του διαλύματος και την ποσότητα της διαλυμένης ουσίας σε γραμμάρια ή mole. Αρχικά, θα ξεκινήσουμε με τον όγκο σε αυτό το σεμινάριο. Ο όγκος του διαλύματος μπορεί να μετρηθεί χρησιμοποιώντας βαθμονομημένο κύλινδρο. Για μοριακότητα, ο όγκος πρέπει να είναι σε μονάδα λίτρων. Εάν ο όγκος εκκίνησης είναι σε χιλιοστόλιτρα, πρέπει να μετατραπεί σε λίτρα πριν υπολογιστεί η μοριακότητα. Υπάρχουν 1000 χιλιοστά στο λίτρο. Έτσι, με έναν απλό υπολογισμό, οποιοσδήποτε όγκος σε χιλιοστόλιτρα μπορεί να μετατραπεί σε λίτρα. Για παράδειγμα, εάν ο όγκος του διαλύματος είναι 100 mL:
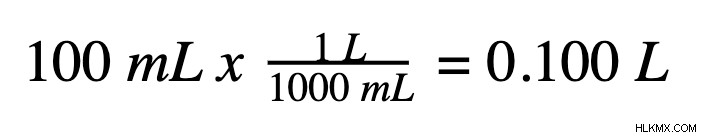
Βήμα 2:
Το δεύτερο βήμα είναι να προσδιοριστεί η ποσότητα της διαλυμένης ουσίας που υπάρχει στο διάλυμα σε mol. Εάν η γνωστή ποσότητα διαλυμένης ουσίας είναι σε γραμμάρια, πρέπει να μετατραπεί σε mole χρησιμοποιώντας μοριακή μάζα. Αν πούμε ότι η διαλυμένη ουσία είναι 5,00 g αμμωνίας (NH3 ), μπορούμε να το μετατρέψουμε σε mol χρησιμοποιώντας τη μοριακή μάζα αμμωνίας (17,04 g/mol):
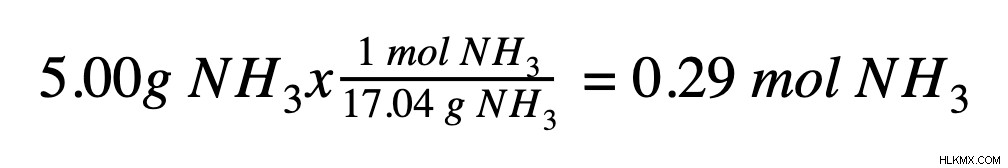
Βήμα 3:
Το τρίτο και τελευταίο βήμα είναι να χρησιμοποιήσετε τον τύπο μοριακότητας και να διαιρέσετε τον αριθμό των γραμμομορίων διαλυμένης ουσίας με τον αριθμό λίτρων του διαλύματος για να λάβετε τη μοριακότητα σε γραμμομόρια ανά λίτρο. Εάν πάρουμε τις δύο τιμές από το προηγούμενο βήμα, βλέπουμε ότι το διάλυμα αμμωνίας είναι 2,9 M. Αυτό σημαίνει ότι κάθε λίτρο αυτού του διαλύματος περιέχει 2,9 moles αμμωνίας.
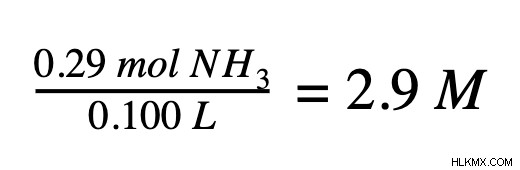
Ένα άλλο παράδειγμα υπολογισμού μοριακότητας
Χρησιμοποιώντας μια διαφορετική ένωση, το χλωριούχο ασβέστιο, μπορούμε να υπολογίσουμε τη μοριακότητα ενός διαλύματος με τον ίδιο τρόπο. Ας ξεκινήσουμε με αυτές τις τιμές:
- 10,0 g CaCl2
- 200 mL H2 O
Ακολουθώντας την ίδια διαδικασία που περιγράφηκε παραπάνω, μπορούμε να προσδιορίσουμε τη μοριακότητα αυτού του διαλύματος χλωριούχου ασβεστίου με μερικά απλά βήματα. Αρχικά, ο όγκος πρέπει να μετατραπεί από χιλιοστόλιτρα σε λίτρα.
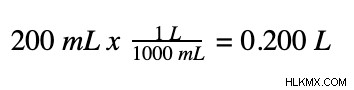
Στη συνέχεια, μετατρέπουμε γραμμάρια χλωριούχου ασβεστίου σε mole.
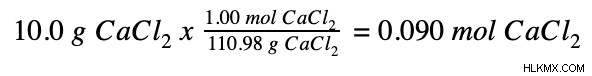
Τέλος, διαιρούμε τον αριθμό των moles με τον όγκο του διαλύματος.
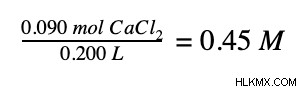
Περαιτέρω ανάγνωση
- Διαδικασία εργαστηρίου:Τιτλοδότηση
- Επιφανειακή τάση και πίεση ατμών
- Λίστα κοινών πολυατομικών ιόντων




