Κατάλογος μετάλλων
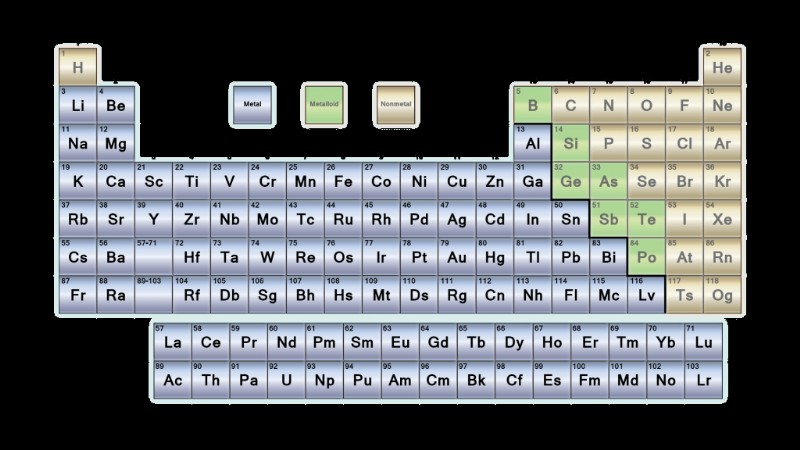
Τα περισσότερα στοιχεία του περιοδικού πίνακα είναι μέταλλα. Ομαδοποιούνται στη μέση προς την αριστερή πλευρά του περιοδικού πίνακα. Τα μέταλλα αποτελούνται από αλκαλικά μέταλλα, αλκαλικές γαίες, μέταλλα μετάπτωσης, λανθανίδες και ακτινίδες.
Ακολουθεί μια λίστα μετάλλων, η θέση τους στον περιοδικό πίνακα, οι ιδιότητες και οι χρήσεις τους.
Ιδιότητες μετάλλων
Τα μέταλλα έχουν πολλές κοινές ιδιότητες, όπως:
- Τα μέταλλα είναι στερεά σε θερμοκρασία δωματίου (με εξαίρεση τον υδράργυρο).
- Τα μέταλλα είναι γυαλιστερά, με μεταλλική λάμψη.
- Με λίγες εξαιρέσεις, τα περισσότερα μέταλλα έχουν υψηλό σημείο τήξης.
- Οι περισσότεροι είναι καλοί αγωγοί της θερμότητας.
- Οι περισσότεροι είναι καλοί ηλεκτρικοί αγωγοί.
- Έχουν χαμηλές ενέργειες ιονισμού.
- Τα μέταλλα έχουν χαμηλή ηλεκτραρνητικότητα.
- Είναι εύπλαστα – μπορούν να κοπούν σε φύλλα.
- Είναι όλκιμο - μπορούν να συρθούν σε καλώδια.
- Τα μέταλλα έχουν τιμές υψηλής πυκνότητας (εξαιρέσεις:λίθιο, κάλιο και νάτριο).
- Τα περισσότερα μέταλλα διαβρώνονται στον αέρα ή το θαλασσινό νερό.
- Τα άτομα μετάλλων χάνουν ηλεκτρόνια στις αντιδράσεις. Σχηματίζουν δηλαδή κατιόντα.
*Γεγονός μπόνους* Κάτω από ορισμένες συνθήκες το υδρογόνο μπορεί να λειτουργήσει ως μεταλλικό στοιχείο. Αυτές οι συνθήκες απαντώνται συνήθως κάτω από ακραίες συνθήκες, όπως υψηλές πιέσεις ή όταν είναι παγωμένο στερεό.
Λίστα μετάλλων
Αυτή είναι μια λίστα μετάλλων κατά σειρά αυξανόμενου ατομικού αριθμού.
| ΑΡΙΘΜΟΣ | ΣΥΜΒΟΛΟ | ELEMENT |
| 3 | Li | Λίθιο |
| 4 | Be | Βηρύλλιο |
| 11 | Όχι | Νάτριο |
| 12 | Mg | Μαγνήσιο |
| 13 | Al | Αλουμίνιο |
| 19 | K | Κάλιο |
| 20 | Περίπου | Ασβέστιο |
| 21 | Sc | Σκάνδιο |
| 22 | Τι | Τιτάνιο |
| 23 | V | Βανάδιο |
| 24 | Cr | Chromium |
| 25 | Mn | Μαγγάνιο |
| 26 | Φε | Σίδερο |
| 27 | Συν | Κοβάλτιο |
| 28 | Ni | Νίκελ |
| 29 | Cu | Χαλκός |
| 30 | Zn | Ψευδάργυρος |
| 31 | Γα | Γάλλιο |
| 37 | Rb | Ρουβίδιο |
| 38 | Sr | Στρόντιο |
| 39 | Ε | Ύττριο |
| 40 | Zr | Ζιρκόνιο |
| 41 | Σημ. | Νιόβιο |
| 42 | Mo | Μολυβδαίνιο |
| 43 | Tc | Τεχνήτιο |
| 44 | Ru | Ρουθήνιο |
| 45 | Rh | Ρόδιο |
| 46 | Pd | Παλλάδιο |
| 47 | Ag | Ασημί |
| 48 | Cd | Κάδμιο |
| 49 | Σε | Ίνδιο |
| 50 | Sn | Κασσίτερος |
| 55 | Cs | Κάσιο |
| 56 | Ba | Βάριο |
| 57 | La | Λανθάνιο |
| 58 | Ε | Cerium |
| 59 | Pr | Πρασεοδύμιο |
| 60 | Δ | Νεοδύμιο |
| 61 | ΜΜ | Προμέθιο |
| 62 | Sm | Σαμάριο |
| 63 | Ευ | Ευρώπιο |
| 64 | Gd | Γαδολίνιο |
| 65 | Tb | Τέρβιο |
| 66 | Dy | Δυσπρόσιο |
| 67 | Ho | Χόλμιο |
| 68 | Ε | Έρβιο |
| 69 | Tm | Θούλιο |
| 70 | Yb | Υτέρβιο |
| 71 | Λου | Λουτέτιο |
| 72 | Hf | Hafnium |
| 73 | Τα | Ταντάλιο |
| 74 | W | Βολφράμιο |
| 75 | Re | Ρήνιο |
| 76 | Λειτουργία | Όσμιο |
| 77 | I | Ιρίδιο |
| 78 | Pt | Πλατινένιο |
| 79 | Au | Χρυσός |
| 80 | Hg | Ερμής |
| 81 | Tl | Θάλλιο |
| 82 | Pb | Προηγούμενος |
| 83 | Bi | Βισμούθιο |
| 84 | Po | Πολώνιο |
| 87 | Fr | Φράγκιο |
| 88 | Ra | Ράδιο |
| 89 | Ac | Ακτίνιο |
| 90 | Θ | Θόριο |
| 91 | Πα | Πρωτακτίνιο |
| 92 | U | Ουράνιο |
| 93 | Np | Ποσειδώνιο |
| 94 | Pu | Πλουτώνιο |
| 95 | Π.μ. | Americium |
| 96 | cm | Κούριο |
| 97 | Bk | Βερκέλιο |
| 98 | Πρ | Καλιφόρνιο |
| 99 | Es | Αϊνστάιν |
| 100 | Fm | Φέρμιο |
| 101 | Md | Μεντελέβιο |
| 102 | Όχι | Nobelium |
| 103 | Lr | Λαυρένιο |
| 104 | Rf | Rutherfordium |
| 105 | Db | Dubnium |
| 106 | Sg | Seaborgium |
| 107 | Bh | Βόριο |
| 108 | Υ | Χάσιο |
| 109 | Mt | Meitnerium |
| 110 | Δ | Darmstadtium |
| 111 | Rg | Roentgenium |
| 112 | Cn | Κοπερνίκιο |
| 113 | Νη | Νιχόνιο |
| 114 | Fl | Flerovium |
| 115 | Mc | Μοσκόβιο |
| 116 | Lv | Livermorium |
Γνωρίστε τα μη μέταλλα
Τα αμέταλλα είναι μια άλλη βασική ομάδα στοιχείων. Ακολουθεί μια λίστα με αυτά και τις ιδιότητές τους.
Τοποθεσία μετάλλων στον περιοδικό πίνακα
Πάνω από το 75% των στοιχείων είναι μέταλλα, επομένως γεμίζουν το μεγαλύτερο μέρος του περιοδικού πίνακα. Τα μέταλλα βρίσκονται στην αριστερή πλευρά του τραπεζιού. Οι δύο σειρές στοιχείων κάτω από το κύριο σώμα του πίνακα (οι λανθανίδες και οι ακτινίδες) είναι μέταλλα.
Χρήσεις μετάλλων
Τα μέταλλα βρίσκουν χρήση σε κάθε πτυχή της ζωής. Ακολουθεί μια λίστα με μερικές από τις χρήσεις τους:
- Δομικά στοιχεία
- Κοντέινερ
- Καλώδια και ηλεκτρικές συσκευές
- Θερμοκράτες
- Καθρέφτες
- Κέρματα
- Κόσμημα
- Όπλα
- Διατροφή (σίδηρος, χαλκός, κοβάλτιο, νικέλιο, ψευδάργυρος, μολυβδαίνιο)
Αναφορές
- Cox P. A. (1997). Τα στοιχεία:Η προέλευση, η αφθονία και η διανομή τους . Oxford University Press:Oxford. ISBN 978-0-19-855298-7.
- Emsley, J. (2003). Τα δομικά στοιχεία της φύσης:Οδηγός Α–Ζ για τα στοιχεία . Oxford University Press. ISBN 978-0-19-850340-8.
- Sosa Torres, Martha; Kroneck, Peter M.H. (2021). Μέταλλα, μικρόβια και ορυκτά:Η βιογεωχημική πλευρά της ζωής . Βερολίνο:Walter de Gruyter. doi:10.1515/9783110589771-001
- Strathern, P. (2000). Το όνειρο του Mendeleyev:The Quest for the Elements . Hamish Hamilton Ltd. ISBN 978-0-241-14065-9.
- Οδός, Α.; Alexander, W. (1998). Μέταλλα στην υπηρεσία του ανθρώπου (11η έκδ.). Penguin Books:Λονδίνο. ISBN 978-0-14-025776-2.




