Εκμάθηση εμπειρικού τύπου – Πώς να υπολογίσετε τον εμπειρικό τύπο

Ο εμπειρικός τύπος ή ο απλούστερος τύπος μιας χημικής ένωσης είναι η απλούστερη αναλογία των στοιχείων που συνθέτουν το μόριο. Αυτές οι αναλογίες συμβολίζονται με δείκτες δίπλα στα σύμβολα των στοιχείων. Αυτό το παράδειγμα προβλήματος θα σας καθοδηγήσει στα βήματα για τον προσδιορισμό του εμπειρικού τύπου μιας ένωσης.
Για παράδειγμα:Ο μοριακός τύπος για το υπεροξείδιο του υδρογόνου είναι H2 O2 . Αυτό σημαίνει ότι υπάρχουν δύο άτομα υδρογόνου και δύο άτομα οξυγόνου σε ένα μόριο υπεροξειδίου του υδρογόνου. Η αναλογία μεταξύ αυτών των στοιχείων είναι 1:1. Για κάθε άτομο υδρογόνου που υπάρχει στο μόριο, υπάρχει ένα άτομο οξυγόνου. Ο εμπειρικός τύπος του υπεροξειδίου του υδρογόνου είναι HO.
Παράδειγμα προβλήματος:
Ένα δείγμα μιας ένωσης βρέθηκε ότι περιέχει 63,5% άργυρο, 8,2% άζωτο και 28,3% οξυγόνο. Ποιος είναι ο εμπειρικός τύπος αυτής της ένωσης;
Λύση:
Βήμα 1: Ας υποθέσουμε ότι έχετε 100 γραμμάρια δείγματος. Αυτό καθιστά ευκολότερο τον προσδιορισμό των ποσοτήτων σε γραμμάρια για κάθε στοιχείο της ένωσης από τις δεδομένες % συνθέσεις.
100 γραμμάρια της ένωσης θα έχουν:
63,5 γραμμάρια ασήμι
8,2 γραμμάρια αζώτου
28,3 γραμμάρια οξυγόνου
Βήμα 2: Μετατρέψτε αυτά τα βάρη σε κρεατοελιές.
Χρησιμοποιήστε έναν περιοδικό πίνακα για να λάβετε τα ατομικά βάρη κάθε στοιχείου.
Ασήμι:107,87 g/mol
Άζωτο:14,01 g/mol
Οξυγόνο:16,00 g/mol
Διαιρέστε το βάρος του δείγματος με το ατομικό βάρος για να λάβετε τον αριθμό των γραμμομορίων κάθε στοιχείου
Ασήμι:

Αζωτο:
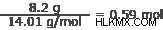
Οξυγόνο:
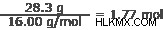
Βήμα 3: Προσδιορίστε τη μικρότερη αναλογία ακέραιων αριθμών μεταξύ αυτών των τιμών.
Το καλύτερο μέρος για να ξεκινήσετε είναι να βρείτε τον μικρότερο αριθμό σπίλων. Σε αυτή την περίπτωση, είναι ασήμι και άζωτο στα 0,59 moles. Διαιρέστε το ποσό κάθε στοιχείου με αυτόν τον αριθμό.
Ασήμι:
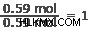
Αζωτο:
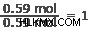
Οξυγόνο:
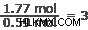
Για κάθε mole αργύρου υπάρχει ένα mole αζώτου και 3 mole οξυγόνου.
Ο εμπειρικός τύπος είναι τότε AgNO3 .
Απάντηση:
Ο εμπειρικός τύπος για αυτήν την ένωση είναι AgNO3 .




